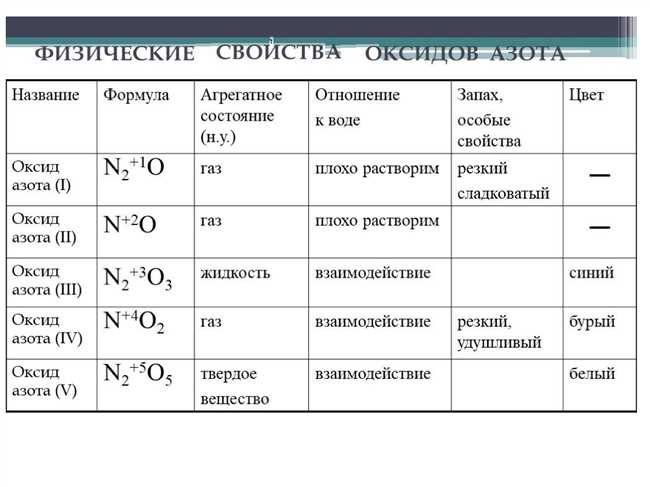
Формула высшего оксида фтора, известного также как фтортетраоксид, обозначается как OF4. Это вещество является одним из самых сильных окислителей, способных реагировать с различными органическими и неорганическими веществами. Фтортетраоксид обладает крайне высокой температурой кипения и является крайне опасным для здоровья человека веществом. Его применение широко распространено в химической промышленности, например, в процессе синтеза фторсодержащих соединений. Ознакомьтесь с подробным объяснением и получите помощь с использованием формулы высшего оксида фтора в настоящей статье.
Что представляет собой формула высшего оксида фтора?
Формула высшего оксида фтора обозначается как OF2, где «O» указывает на присутствие кислорода, а «F2» указывает на две молекулы фтора. Этот оксид относится к классу химических соединений, известных как оксиды фтора.
Оксиды фтора являются кислородсодержащими соединениями, в которых фтор встречается в различных степенях окисления. Формула OF2 указывает на то, что фтор в оксиде имеет окислительное состояние +2.
Формула OF2 означает, что в молекуле есть один атом кислорода и два атома фтора. Каждый атом фтора образует химическую связь с атомом кислорода, образуя две одиночные связи (O-F). Кислородный атом имеет две связи с фтором, и каждый фторовый атом имеет одну связь с кислородом.
Формула OF2 позволяет определить соотношение атомов фтора и кислорода в молекуле, а также указывает на то, что между кислородом и фтором есть химическая связь. Это позволяет ученым лучше понять химические свойства и реакции изучаемого соединения.
Высший оксид фтора (OF2) — это газообразное вещество, без цвета и запаха. Он обладает сильными окислительными свойствами и может быть опасным для человека и окружающей среды.
Итак, формула высшего оксида фтора (OF2) представляет собой химическое соединение, состоящее из одного атома кислорода и двух атомов фтора, связанных между собой.
Оксид фтора и его свойства
1. Высокая реакционная способность: Оксид фтора является очень реакционным веществом. Он способен реагировать с большим количеством других веществ, включая металлы, органические соединения и даже стекло. Это делает его полезным во многих процессах и промышленных приложениях.
2. Сильное окислительное действие: Оксид фтора является одним из самых мощных окислителей. Он способен окислять многие вещества, включая металлы, неметаллы и органические соединения. Это свойство оксида фтора делает его важным в процессе получения высокоокисленных соединений.
3. Взаимодействие с водой: Оксид фтора реагирует с водой, образуя фтороводородную кислоту и кислород. Эта реакция очень быстрая и сопровождается выделением большого количества тепла. Поэтому взаимодействие оксида фтора с водой необходимо проводить с осторожностью и в специальных условиях.
4. Высокая температура кипения: Оксид фтора имеет очень низкую температуру кипения, которая составляет всего лишь -144 градуса Цельсия. Это делает его интересным объектом для исследования и использования в низкотемпературных процессах.
5. Фторирование металлов: Оксид фтора широко используется для фторирования различных металлов. Этот процесс позволяет повысить их химическую стабильность и устойчивость к окислению. Фторированные металлы находят применение в различных отраслях промышленности, включая производство лекарственных препаратов и электронику.
В целом, оксид фтора обладает уникальными свойствами, которые делают его полезным в различных областях науки и промышленности. Его высокая реакционная способность и сильное окислительное действие позволяют использовать его для получения новых соединений и улучшения свойств материалов.
Химическая формула высшего оксида фтора

Химическую формулу OF2 можно прочитать как «оксид фтора валентности 2», что означает, что оксид состоит из двух атомов фтора и одного атома кислорода. Атомы фтора имеют отрицательный заряд, а атом кислорода — положительный заряд, что делает OF2 веществом с электрокоординационной природой связей.
OF2 — это ядовитый газ с ярко-желтой окраской, обладающий резким запахом и сильной окислительной активностью. Он легко диссоциирует при повышенных температурах, образуя атомарный фтор (F2) и кислород (O2).
Высший оксид фтора применяется в качестве окислителя в процессе получения трития (изотопа водорода) и других органических соединений, а также в производстве галогенидов металлов. OF2 также активно используется в качестве фторирующего агента, с помощью которого производятся фториды различных элементов.
Кроме того, высший оксид фтора применяется в процессе производства полупроводниковых устройств, разработки ракетных топлив и во многих других областях науки и промышленности.
В целом, OF2 — это очень важное соединение, которое играет ключевую роль во многих технологических процессах и находит применение в различных областях науки и промышленности.
Использование формулы высшего оксида фтора
Окислительные свойства
Формула высшего оксида фтора используется в качестве сильного окислителя в различных химических процессах. Она способна окислять многие вещества, включая металлы, неорганические соединения и органические вещества. Благодаря этой способности она используется в производстве фторированных соединений, в процессах очистки воды и в производстве различных химических продуктов.
Роль в органической химии
Формула высшего оксида фтора играет важную роль в органической химии. Она используется для синтеза сложных органических соединений и модификации структуры органических молекул. Ее применение позволяет получать новые соединения с уникальными свойствами и реакционной способностью. Это помогает в разработке новых лекарственных препаратов, пластиков, катализаторов и других продуктов органической химии.
Катализатор
Формула высшего оксида фтора является эффективным катализатором в различных химических реакциях. Она способна активировать реакцию, ускоряя скорость химической реакции и повышая ее эффективность. Это особенно полезно в процессах промышленного производства, где требуется быстрое и эффективное проведение реакции.
Таким образом, формула высшего оксида фтора, F2O7, является важным соединением, которое находит широкое применение в различных областях науки и техники. Ее использование как окислителя, реагента в органической химии и катализатора позволяет получать новые соединения с уникальными свойствами и помогает в развитии современных технологий и продуктов.






