- Ангидриды: что это и зачем нужно знать?
- Структура ангидридов
- Физические свойства ангидридов
- 1. Точка плавления и кипения
- 2. Растворимость
- 3. Форма кристаллов
- 4. Электропроводность
- 5. Оптические свойства
- Химические свойства ангидридов
- 1. Реакция с водой
- 2. Кислотные свойства
- 3. Реакция с основаниями
- 4. Реакция с аминами
- 5. Инертность
- Применение ангидридов в промышленности
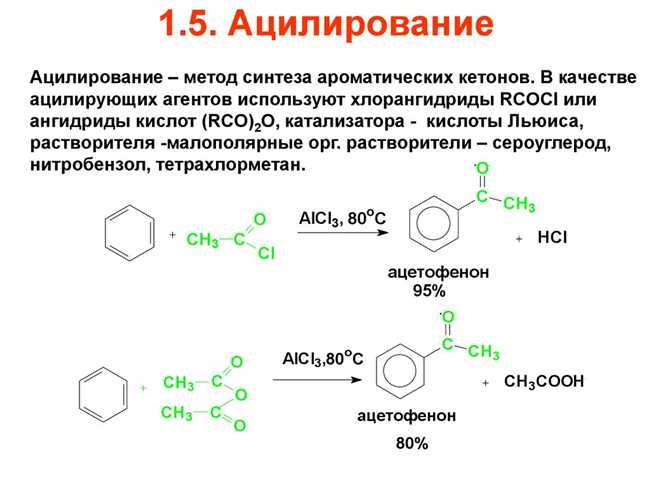
Ангидрид – это химическое соединение, которое образуется при удалении воды из кислоты или ее соли. Они могут быть органическими или неорганическими и широко применяются в различных областях нашей жизни.
Одним из наиболее известных ангидридов является углекислый газ (СО2), который образуется в процессе дыхания, горения и других промышленных процессах. Он является основным газом, вызывающим парниковый эффект и влияющим на изменение климата.
Ангидриды также играют важную роль в производстве промышленных и бытовых товаров. Например, аммиачный ангидрид используется для производства удобрений, а серный ангидрид – для производства бумаги и текстиля.
В медицине ангидриды применяются для производства лекарственных препаратов, в том числе анальгетиков и антибиотиков.
Ознакомившись с этой статьей, вы узнаете больше о роли ангидридов в нашей жизни и о том, как они влияют на окружающую среду и наше здоровье.
Ангидриды: что это и зачем нужно знать?
Зачем нужно знать об ангидридах? Во-первых, они широко используются в процессе производства различных материалов, таких как пластик, стекло и керамика. Например, ангидрид серной кислоты (SO3) является основным компонентом батарейных кислот и играет важную роль в производстве удобрений и лекарственных препаратов.
Во-вторых, ангидриды широко используются в химической промышленности для синтеза различных соединений. Например, ангидрид уксусной кислоты (CH3CO2) используется для получения уксусной кислоты, которая в свою очередь широко применяется в пищевой и фармацевтической промышленности.
Кроме того, ангидриды играют важную роль в органической химии, так как они часто используются как реагенты для ввода функциональных групп в органические молекулы. Например, ангидрид ацетилсалициловой кислоты (ASA) используется для получения аспирина, популярного противовоспалительного и обезболивающего препарата.
Интересно отметить, что ангидриды могут также играть важную роль в природных процессах. Некоторые ангидриды, такие как азотистый ангидрид (N2O5), являются важными реагентами в атмосферных процессах, включая образование кислотных дождей.
- Ангидриды являются химическими соединениями, которые образуются при соединении кислорода с не металлическими элементами.
- Они имеют широкий спектр применений и используются в различных отраслях науки и промышленности.
- Ангидриды широко используются в производстве материалов, химической и фармацевтической промышленности.
- Они играют важную роль в органической химии и могут быть использованы в природных процессах.
Теперь, когда вы знаете, что такое ангидриды и зачем это важно, вы можете лучше понять их значимость в нашей повседневной жизни и в различных областях науки и промышленности.
Структура ангидридов
Структура ангидридов основана на присутствии кислородных атомов, связанных с другими элементами или группами. Одна из наиболее распространенных структур ангидридов — это дважды замещенные кислородом группы, которые обладают химической активностью и могут образовывать связи с другими атомами. Эта структура позволяет ангидридам проявлять кислотные или щелочные свойства в зависимости от их взаимодействия с другими соединениями.
Однако структура ангидридов может также варьироваться в зависимости от конкретного соединения. Например, сернистый ангидрид (SO2) имеет линейную структуру, в которой два атома кислорода связаны с атомом серы. В то же время, азотистый ангидрид (N2O5) обладает сложной структурой, где атомы азота и кислорода образуют вершину треугольной пирамиды.
Некоторые ангидриды могут образовывать полимеры, в результате чего их структура становится более сложной. Например, полимеры карбоновых ангидридов (например, полиангидрид и метилангидрид) имеют длинные цепочки, состоящие из повторяющихся остатков.
Таблица
| Название ангидрида | Химическая формула | Структура |
|---|---|---|
| Сернистый ангидрид | SO2 | Линейная |
| Азотистый ангидрид | N2O5 | Треугольная пирамида |
| Уксусный ангидрид | (CH3CO)2O | Дважды замещенные кислородом группы |
Как видно из примеров, структура ангидридов может быть разнообразной и зависит от типа атомов, связей и групп, с которыми они взаимодействуют. Знание структуры ангидридов помогает понять их свойства и реакционную способность, что может быть полезно в контексте их применения в различных областях, включая химическую промышленность, фармацевтику и материаловедение.
Физические свойства ангидридов
1. Точка плавления и кипения
У большинства ангидридов есть определенная точка плавления и кипения. Например, серная кислота, один из наиболее известных ангидридов, имеет точку плавления около 10 градусов Цельсия и точку кипения около 338 градусов Цельсия. Эти значения могут варьироваться в зависимости от конкретного ангидрида.
2. Растворимость
Ангидриды могут быть растворимыми или нерастворимыми в различных растворителях, таких как вода или органические растворители. Комплексные соединения обычно обладают более высокой растворимостью, чем простые ангидриды.
3. Форма кристаллов
Кристаллическая структура ангидридов может варьироваться в зависимости от различных факторов, таких как условия затвердевания или присутствие других веществ. Некоторые ангидриды формируют кристаллы, имеющие определенную форму, что делает их удобными для использования в кристаллографических исследованиях.
4. Электропроводность
Ангидриды в твердом состоянии обычно являются непроводниками электричества. Однако, когда они находятся в жидком состоянии или в растворе, они могут проявлять электропроводность. Например, серная кислота, которая является ангидридом серной кислоты, обладает хорошей электропроводностью в растворе. Это можно объяснить наличием ионов, образующихся при диссоциации ангидрида в воде.
5. Оптические свойства

Некоторые ангидриды имеют интересные оптические свойства. Например, ангидрид молочной кислоты может образовывать кристаллы, которые имеют оптическую хиральность – способность поворачивать плоскость поляризации света. Эти оптические свойства широко используются в фармацевтической и химической промышленности.
Теперь, когда вы знаете некоторые физические свойства ангидридов, вы сможете лучше понять их использование и воздействие на окружающую среду. Представьте, какие удивительные возможности предоставляют нам эти соединения!
Химические свойства ангидридов
1. Реакция с водой
Ангидриды обладают высокой реакционной способностью с водой. При контакте с водой они могут вызывать сильное нагревание, выброс паров и образование кислот. Например, сернистый ангидрид (SO2) взаимодействует с водой, образуя сульфитную кислоту (H2SO3).
2. Кислотные свойства
Ангидриды являются кислотными соединениями и могут образовывать кислоты при реакции с водой или другими основаниями. Например, сульфурный ангидрид (SO3) реагирует с водой, образуя сульфатную кислоту (H2SO4). Это свойство ангидридов позволяет им играть важную роль в производстве различных кислот и солей.
3. Реакция с основаниями
Ангидриды также могут реагировать с основаниями, образуя соли. Например, сернистый ангидрид (SO2) реагирует с гидроксидом натрия (NaOH), образуя сульфит натрия (Na2SO3). Это свойство ангидридов широко используется в производстве различных солей и промышленных процессах.
4. Реакция с аминами
Некоторые ангидриды могут реагировать с аминами, образуя соответствующие амиды. Например, уксусный ангидрид (CH3CO2O) реагирует с анилином (C6H5NH2), образуя ацетанилид (CH3CONHC6H5). Это свойство ангидридов находит применение в органическом синтезе и производстве лекарственных препаратов.
5. Инертность
Некоторые ангидриды обладают инертными свойствами, то есть они не реагируют с водой или другими растворителями при обычных условиях. Например, азотистый ангидрид (N2O3) является инертным газом и используется в качестве окислителя в реакциях.
В итоге, ангидриды — это важные химические соединения с разнообразными свойствами. Они играют роль в производстве кислот, солей, органических соединений и находят применение в различных промышленных процессах и исследованиях.
Применение ангидридов в промышленности
Одним из основных применений ангидридов является их использование в процессе синтеза полимеров. Ангидриды активно используются в производстве пластиков, красителей, смол и клеев. Они способствуют образованию кросс-связей между молекулами полимера, придавая ему прочность и устойчивость к различным внешним воздействиям.
Еще одной важной областью применения ангидридов является их использование в процессе производства лекарственных препаратов. Ангидриды входят в состав многих лекарственных форм, таких как таблетки, капсулы и растворы. Они служат связующим веществом, обеспечивая стабильность и эффективность лекарственного препарата.
Кроме того, ангидриды находят применение в производстве пищевых добавок и ароматизаторов. Они используются для образования эфирных масел, которые придают продуктам особый аромат и вкус. Ангидриды также могут использоваться в качестве консервантов, предотвращая развитие микроорганизмов и продлевая срок годности продукта.
Таким образом, ангидриды играют важную роль в промышленности, обеспечивая эффективность и качество производимых продуктов. Их использование позволяет создавать новые материалы, улучшать свойства существующих и применять их в различных отраслях промышленности.






