Железо (Fe) является химическим элементом, расположенным в периодической системе в 8-й группе, валентностью 2+. Это означает, что в химических соединениях железо может образовывать ион с положительным зарядом 2. Однако в различных соединениях валентность железа может меняться. Например, в соединении FeCl2 железо присутствует в форме иона Fe2+, а в FeCl3 – в форме иона Fe3+. Также, валентность железа может быть различной в разных типах соединений, таких как оксиды, сульфаты и другие. Понимание того, какая валентность у железа в различных соединениях, играет важную роль в понимании его свойств и возможностей использования в различных областях науки и промышленности.
Железо: валентность и ее изменения
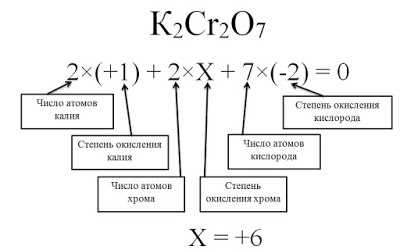
Валентность – это способность атома образовывать связи с другими атомами. Она указывает на количество электронов, которые атом железа может отдать или принять при образовании химических связей. В случае железа, его валентность может изменяться в зависимости от характера соединения.
Самая распространенная валентность железа – +2 и +3. В соединениях с валентностью +2 атом железа отдает два электрона, образуя два положительных иона. Примерами соединений с валентностью +2 являются оксид железа II FeO, сульфид железа II FeS и гидроксид железа II Fe(OH)2. Эти соединения имеют различные свойства и применяются в разных сферах науки и промышленности.
Соединения со вторичной валентностью +3 являются также очень распространенными. Железо отдает три электрона, образуя три положительных иона. Примеры таких соединений включают оксид железа III Fe2O3, сульфид железа III Fe2S3 и хлорид железа III FeCl3. Они имеют свои уникальные свойства и широко используются в различных областях науки и промышленности.
- Валентность железа может изменяться в разных соединениях в зависимости от окружающих атомов и условий.
- Знание валентности железа позволяет химикам предсказывать его химические свойства и возможные реакции.
- Изменение валентности железа играет важную роль в проведении электролиза и различных химических реакций.
Таким образом, валентность железа может изменяться в разных соединениях в зависимости от условий и окружающих атомов. Это свойство делает железо универсальным элементом и позволяет ему образовывать различные химические связи. Понимание валентности железа является важным для химиков и научных исследователей, так как оно помогает предсказать его химические свойства и создавать новые материалы и соединения для различных приложений и технологий.
Валентность железа
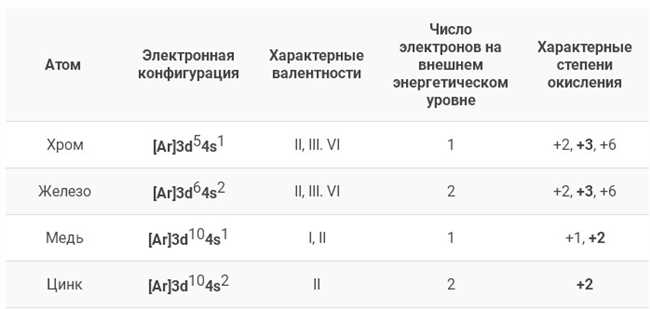
Валентность — это число, которое показывает, сколько электронов элемент сможет получить, отдать или поделить во время химической реакции. Чтобы определить валентность железа, мы должны прежде всего посмотреть на его электронную конфигурацию.
Железо имеет 26 электронов, распределенных на четырех энергетических уровнях: K (2 электрона), L (8), M (14) и N (2). Внешний энергетический уровень N содержит всего 2 электрона, что является основным фактором, определяющим валентность железа.
Возможные варианты валентности железа включают +2 и +3. В состоянии +2 железо теряет свои два внешних электрона, чтобы достичь стабильности, в то время как в состоянии +3 оно теряет все три внешних электрона. Это означает, что железо имеет способность вступать в соединения, в которых может выступать как двухвалентное или трехвалентное вещество.
Какая валентность у железа в конкретном соединении зависит от окружающих его атомов и условий реакции. Например, в соединениях с кислородом, как Fe2+ и Fe3+, железо образует ионы с разной валентностью. Также, в некоторых случаях, если железо находится в окружении других элементов, его валентность может изменяться.
Важно понимать, что валентность железа — это не постоянная величина, а зависит от конкретной химической реакции. Это позволяет железу быть гибким веществом, способным взаимодействовать с различными элементами и образовывать разнообразные соединения.
Итак, валентность железа может меняться в разных соединениях, и это делает его универсальным и востребованным элементом в различных областях. Понимание валентности железа поможет лучше осознать его реакционные возможности и применение в различных химических процессах.
Изменение валентности железа в разных соединениях
Железо может иметь две основные валентности — Fe2+ (железо(II)) и Fe3+ (железо(III)). В железо(II) у железа есть два лишних электрона, которые могут быть переданы другому атому или группе атомов. В железо(III) у железа три лишних электрона, которые также могут участвовать в реакциях.
Изменение валентности железа возможно благодаря его способности образовывать различные химические связи. В различных соединениях железа, оно может быть связано с различными элементами, такими как кислород, сера, азот и другие. Это приводит к изменению его валентности и химическим свойствам. Например, в соединении ферроксид (FeO), железо имеет валентность Fe2+, а в соединении гематит (Fe2O3) — валентность Fe3+.
В таблице представлены некоторые общие соединения железа и их валентности:
| Соединение | Валентность железа |
|---|---|
| FeO | Fe2+ |
| Fe2O3 | Fe3+ |
| FeCl2 | Fe2+ |
| FeCl3 | Fe3+ |
Это лишь некоторые примеры, и валентность железа может быть различной в разных соединениях. Изменение валентности обусловлено разным количеством электронов, которые железо может передавать при образовании связей с другими элементами. Это свойство делает железо уникальным и позволяет ему образовывать различные химические соединения с разными свойствами.
Важно отметить, что валентность железа не может быть изменена произвольно, она определяется его электронной конфигурацией и условиями реакции. Изменение валентности железа является результатом химической реакции и взаимодействия с другими соединениями.






