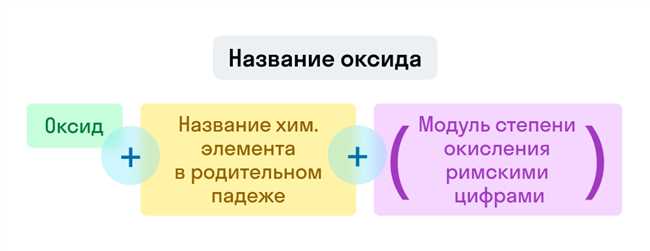
Оксид OH, более известный как гидроксид, играет важную роль в составе щелочных соединений. Валентность этого оксида влияет на его химические свойства и его способность взаимодействовать с другими веществами.
Валентность оксида OH определяется количеством электронов, которые оно может передать или принять в химической реакции. В щелочных соединениях гидроксиды содержат один атом гидроксильной группы (OH-) и обычно имеют валентность -1.
Валентность оксида OH помогает определить его реактивность и его способность образовывать соли с другими элементами. Гидроксиды, содержащие гидроксильную группу OH-, широко используются в промышленности и в нашей повседневной жизни, включая производство щелочей, мыла и медикаментов.
Щелочные соединения, содержащие оксид OH
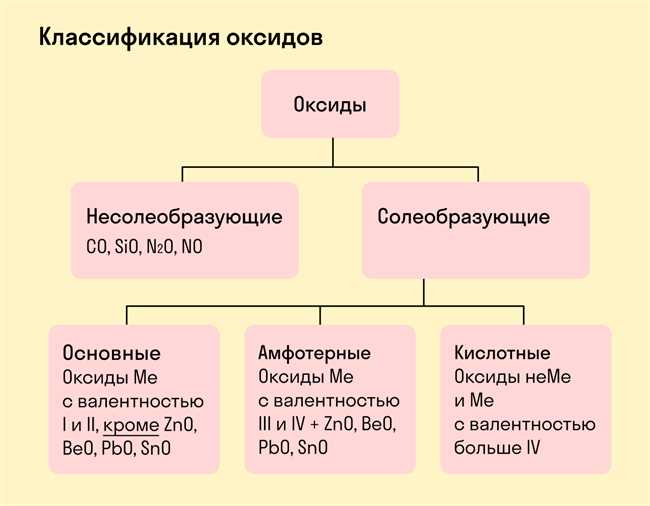
Оксид OH является гидроксидом, содержащим группу OH-. В щелочных соединениях, таких как гидроксид натрия (NaOH) или гидроксид калия (KOH), группа OH- играет важную роль. Она является основным антионом в этих соединениях и обладает основными свойствами.
- Оксид OH в щелочных соединениях является сильной основой. Он обладает способностью принимать протоны (H+) и образовывать гидроксидные ионы (OH-). Это свойство делает щелочные соединения незаменимыми в множестве химических реакций и процессов.
- Оксид OH также обладает высокой растворимостью в воде. Гидроксидные ионы OH- хорошо диссоциируют в водной среде, образуя щелочные растворы. Это позволяет использовать щелочные соединения в качестве химических реагентов и веществ для регулирования рН среды.
Кроме того, оксид OH в щелочных соединениях может образовывать соли с кислотными соединениями. Например, реакция между гидроксидом натрия (NaOH) и соляной кислотой (HCl) приводит к образованию соли — хлорида натрия (NaCl) и воды:
NaOH + HCl → NaCl + H2O
Это позволяет использовать щелочные соединения в процессах нейтрализации и регулирования кислотно-щелочного баланса.
Структура и свойства оксида OH в щелочных соединениях
Структура гидроксида определяется соединением одного атома кислорода и одного атома водорода. При этом атомы связаны ковалентной связью, где электроны общие и находятся в области между атомами. Эта связь обладает полярным характером, так как атом кислорода сильнее притягивает электроны, создавая положительный и отрицательный полюса.
Свойства гидроксида OH определяются его полярной структурой. Оно обладает высокой растворимостью в воде, так как полярные молекулы воды образуют водородные связи с отрицательно заряженными гидроксидными и положительно заряженными водородными ионами. Это делает его одним из ключевых компонентов щелочных растворов и обеспечивает их щелочные свойства.
Гидроксиды часто проявляют амфотерные свойства, то есть могут действовать как кислоты и основания. Это связано с возможностью взаимодействия оксида OH с различными кислотами или основаниями. В результате таких реакций образуются соли и вода.
Применение гидроксидов разнообразно и находит применение в различных отраслях. Например, щелочные растворы на основе гидроксида OH используются в процессе сапонификации при производстве мыла и моющих средств. Они также применяются в живописи, в процессе нейтрализации кислот и даже в фармацевтической промышленности как ингредиенты в препаратах.
В заключении, гидроксид OH является важным составляющим щелочных соединений и обладает своей уникальной структурой и свойствами. Химические свойства этого соединения определяют его функциональность и применение в различных сферах.
Формирование и разложение валентности оксида OH в щелочных соединениях
Формирование валентности оксида OH происходит при взаимодействии металла с гидроксидом. Например, реакция натрия с водой (Na + H2O) приводит к образованию гидроксида натрия (NaOH) и выделению водорода (H2). В этом случае оксидная группа OH получает валентность -1, так как натрий отдает свой валентный электронный позвоночник группе OH.
Разложение валентности оксида OH может происходить при нагревании или взаимодействии с другими веществами. Например, путем нагревания гидроксида натрия (NaOH) оксидная группа OH может разлагаться на воду (H2O) и кислород (O2). В этом случае валентность оксида OH снижается до 0.
Валентность оксида OH в щелочных соединениях зависит от свойств металла и окружающей среды. Некоторые металлы, такие как натрий и калий, имеют склонность отдавать свои валентные электроны, что приводит к формированию оксида с валентностью -1. Другие металлы, такие как магний и алюминий, имеют более сложную валентность оксида OH (-1 или -2), которая зависит от окружающей среды и степени окисления металла.
Исследования формирования и разложения валентности оксида OH имеют важное значение для понимания химических реакций и разработки новых материалов. Они позволяют улучшить процессы производства и использования щелочных соединений, а также разработать новые методы синтеза и модификации веществ. Понимание механизмов формирования и разложения валентности оксида OH способствует развитию науки и применению ее достижений в различных областях, таких как металлургия, электрохимия и катализ.
Применение в промышленности и научных исследованиях
Оксид OH, образующийся в щелочных соединениях, имеет широкий спектр применения в различных областях промышленности и научных исследований.
В промышленности оксид OH используется в процессе производства щелочных растворов, используемых в текстильной, пищевой и фармацевтической промышленности. Он служит важным компонентом при производстве мыла, моющих средств и косметических продуктов. Также он применяется в процессе электролиза при выделении продуктов ионизации из растворов солей.
В научных исследованиях оксид OH играет значительную роль в анализе и идентификации различных соединений. Он применяется в спектрофотометрии для определения концентрации ионов и молекул в растворе. Также он является важным ингредиентом при проведении экспериментов по изучению химических реакций и катализаторов, а также в создании новых материалов с уникальными свойствами.






