
Когда мы соединяем медь (Cu) с азотной кислотой (HNO3), происходит реакция, которая порождает продукты и образует неуравновешенное химическое уравнение. Чтобы правильно составить уравнение и уравнять его с помощью электронного баланса, мы должны знать химические свойства и реактивные способности каждого компонента.
В данном случае, реакция между медью и азотной кислотой приводит к образованию нитрат меди (Cu(NO3)2) и оксида азота (NO) в качестве продуктов. Однако, чтобы получить полностью уравновешенное химическое уравнение, необходимо учесть соблюдение закона сохранения массы и заряда.
Электронный баланс позволяет отследить перенос электронов во время реакции и корректировать коэффициенты перед соответствующими веществами. Используя электронный баланс, можно достичь полной уравновешенности химического уравнения для реакции меди с азотной кислотой. Это позволяет получить правильные коэффициенты перед реагентами и продуктами, отражающие их соотношение по количеству и заряду.
Таким образом, для заключения уравнения между Cu и HNO3 и его уравновешивания с помощью электронного баланса, требуется учет химических свойств и применение правил балансировки, обеспечивающих соблюдение законов сохранения массы и заряда.
Складывание и уравнивание уравнения реакции Cu+HNO3
Медь — это металлический элемент, который обладает прекрасными электропроводными свойствами и широко используется в различных отраслях промышленности, включая электротехнику и строительство.
Азотная кислота, или HNO3, это химическое соединение, которое широко применяется в производстве удобрений, пластмасс и других химических веществ.
Теперь, когда мы знакомы с этими веществами, давайте перейдем к реакции между ними. Уравнение для реакции между медью и азотной кислотой выглядит следующим образом:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
В этом уравнении медь реагирует с азотной кислотой, образуя нитрат меди (Cu(NO3)2), два молекулы оксида азота (NO2) и две молекулы воды (H2O). Числа перед каждым веществом указывают на количество молекул каждого вещества, участвующих в реакции.
Теперь перейдем к уравниванию этого уравнения с помощью электронного баланса. На первый взгляд может показаться, что это сложная задача, но на самом деле все довольно просто.
Сначала нам нужно уравнять количество атомов каждого элемента справа и слева от стрелки реакции. Для этого мы можем использовать коэффициенты перед каждым веществом.
Итак, мы имеем один атом меди на левой стороне и один атом меди на правой стороне. Теперь нам нужно уравнять количество атомов азота. На левой стороне у нас четыре атома азота в азотной кислоте, а на правой — два атома азота в нитрате меди и два атома азота в оксиде азота.
Чтобы уравнять атомы азота, мы можем добавить коэффициент 2 перед HNO3 и коэффициент 2 перед NO2. Теперь у нас будет 4 атома азота на обеих сторонах уравнения.
Таким образом, уравнение после уравнивания будет выглядеть так:
2Cu + 8HNO3 → 2Cu(NO3)2 + 4NO2 + 4H2O
Теперь у нас уравнено количество атомов каждого элемента, и мы можем быть уверены в правильности нашего уравнения реакции.
Надеюсь, эта информация была полезной для тебя! Если у тебя возникли еще вопросы, не стесняйся задавать их мне. Хорошего дня!
Описание реакции Cu+HNO3
Уравнение реакции можно записать следующим образом:
3Cu + 8HNO3 → 3Cu(NO3)2+2NO + 4H2O
При растворении меди в азотной кислоте, медь приходит в раствор в форме медных ионов (Cu^2+), а в результате процесса происходит выделение оксида азота(II) (NO). Дальнейшая реакция приводит к образованию медного нитрата (Cu(NO3)2) и воды (H2O).
Эта реакция является экзотермической, то есть при ее протекании выделяется теплота. При взаимодействии меди и азотной кислоты может наблюдаться выделение пузырьков газа, вызванное выделением оксида азота(II) (NO).
Данная реакция является примером восстановления восходящей степени меди, так как медь Cu^+ вступает в реакцию с азотной кислотой и окисляется до иона меди Cu^2+.
Для уравнивания данного уравнения реакции можно использовать метод электронного баланса. Не забывайте, что все атомы должны сбалансироваться и сумма зарядов на каждой стороне уравнения должна быть равной.
Добавление азотной кислоты к меди может вызывать интересные эффекты и применимость этой реакции. Учитывая применимость данной реакции, она может использоваться для анализа содержания меди в различных образцах и материалах.
В итоге, реакция меди (Cu) с азотной кислотой (HNO3) представляет собой окислительно-восстановительную реакцию, в результате которой медь окисляется, выделяется оксид азота(II) (NO) и образуется медный нитрат (Cu(NO3)2) и вода (H2O). Процесс можно уравнять с помощью метода электронного баланса, гарантируя сбалансированное уравнение и полное понимание данной реакции.
Закончение уравнения реакции
Когда мы решаем химическую реакцию, включающую в себя соединения, иногда может оказаться сложно определить точное закончение уравнения. Однако, с определенными навыками и знаниями, мы можем успешно уравнять уравнение, включающее Cu+HNO3.
Давайте начнем с расщепления реагентов на ионы. Когда медь вступает в реакцию с азотной кислотой, она окисляется и образует ион меди (Cu2+). Азотная кислота отдает один из своих атомов кислорода и образует нитратный ион (NO3-).
Теперь у нас есть ион меди и нитратный ион. Чтобы уравнять уравнение, мы должны соблюсти закон сохранения массы и заряда. В данном случае, мы имеем одномолекулярный катион (Cu2+) и трехмолекулярный анион (NO3-).
Мы можем закончить уравнение, поместив ион Cu2+ слева и ион NO3- справа. Таким образом, окончательное уравнение будет выглядеть следующим образом:
Cu + 2 HNO3 -> Cu(NO3)2 + NO + H2O
Теперь у нас есть уравновешенное уравнение, которое показывает, что одна молекула меди реагирует с двумя молекулами азотной кислоты, образуя одну молекулу нитрата меди, нитроокись азота и молекулу воды.
Закончив уравнение реакции между Cu и HNO3, мы можем продолжить наше исследование, изучая другие химические реакции или применяя это знание на практике. Успехов вам в химии!
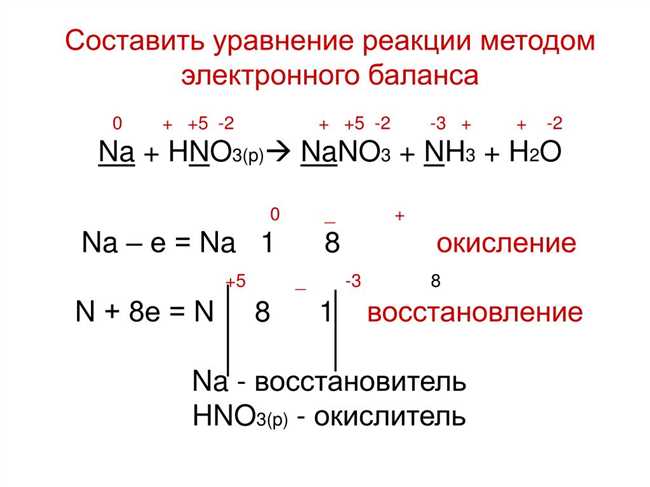
Уравнивание уравнения с помощью электронного баланса
Итак, как мы можем уравнять уравнение Cu + HNO3? Давайте рассмотрим этот пример.
Сначала определим вещества, участвующие в реакции: медь (Cu) и азотная кислота (HNO3). Пришло время определить окислитель и восстановитель.
Окислитель — это вещество, которое принимает электроны в химической реакции. Восстановитель — вещество, которое отдает электроны. В данном случае медь (Cu) вступает в реакцию как восстановитель, а азотная кислота (HNO3) — как окислитель.
Теперь приступим к самому уравниванию уравнения с помощью электронного баланса. Начнем с добавления коэффициентов перед соответствующими веществами, чтобы сделать количество атомов каждого элемента одинаковым с обеих сторон реакции.
Вот как может выглядеть итоговое уравнение:
| Не сбалансированное уравнение | Сбалансированное уравнение |
|---|---|
| Cu + HNO3 | Cu(NO3)2 + NO + H2O |
Теперь у нас есть одинаковое количество атомов каждого элемента с обеих сторон реакции.
Как видите, использование электронного баланса позволило нам сбалансировать уравнение, учитывая переход электронов от восстановителя к окислителю. Этот метод позволяет нам более точно представить реакцию и понять, как происходят изменения веществ в процессе химической реакции.
Уравнивание уравнения с помощью электронного баланса не только помогает нам в изучении химии, но и находит применение во множестве сфер: от химической промышленности до разработки новых лекарств и материалов.
Ура! Мы успешно уравняли уравнение Cu + HNO3 с помощью электронного баланса. Надеюсь, теперь вы чувствуете себя увереннее в этом процессе и можете приступить к уравниванию других уравнений. Удачи в изучении химии!
Расчет электронного баланса

Расчет электронного баланса играет важную роль в химических реакциях, таких как окислительно-восстановительные реакции. Это позволяет определить количество электронов, передающихся между реагентами и продуктами реакции.
Для расчета электронного баланса нужно учесть, какие элементы входят в соединения и каким образом они взаимодействуют. Реакция между медью (Cu) и азотной кислотой (HNO3) представляет собой окислительно-восстановительную реакцию, поскольку медь окисляется, а азотная кислота восстанавливается.
Окисление меди происходит по следующему уравнению:
Cu → Cu2+ + 2e—
Таким образом, одна медь (Cu) окисляется до иона меди Cu2+ с потерей двух электронов.
С другой стороны, азотная кислота (HNO3) восстанавливается по следующему уравнению:
HNO3 + 3H2O + 3e— → NO2— + 2OH—
В результате азотная кислота (HNO3) восстанавливается до иона NO2— с образованием двух ионов гидроксида (OH—) и выделением трех электронов.
Чтобы уравновесить электронный баланс, необходимо учесть, что описание окисления меди требует двух электронов, в то время как азотная кислота требует трех электронов. Из этого следует, что для двух меди (Cu) потребуется три азотной кислоты (HNO3).
Итак, окончательное уравнение с учетом электронного баланса будет выглядеть следующим образом:
2Cu + 6HNO3 → 2Cu(NO3)3 + 3H2O + 3NO2— + 4OH—
Таким образом, для балансировки реакции Cu + HNO3 мы использовали две меди (Cu), шесть азотных кислот (HNO3) и получили два иона меди (Cu(NO3)3), три молекулы воды (H2O), три иона оксида азота (NO2-) и четыре иона гидроксида (OH-).
Финальное уравнение реакции Cu+HNO3
При реакции между медью (Cu) и соляной кислотой (HNO3) происходит окислительно-восстановительная реакция, в результате которой образуются куприт (Cu2O), азотная кислота (HNO3) и вода (H2O).
Вот финальное уравнение этой реакции:
- 2Cu + 4HNO3 -> 2 Cu(NO3)2 + Cu2O + 2H2O + NO2






