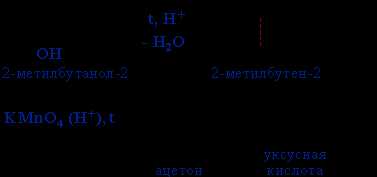
- Окисление этилового спирта KMnO4, H2SO4
- Химический состав и свойства этилового спирта
- Химический состав
- Свойства
- Использование этилового спирта
- Химический состав и свойства KMnO4
- Химический состав и свойства H2SO4
- Процесс окисления этилового спирта KMnO4, H2SO4
- Химическое уравнение
- Описание процесса
- Полное уравнение окисления этилового спирта KMnO4, H2SO4
- Зависимость процесса окисления от коэффициентов
Уравнение окисления этилового спирта KMnO4, H2SO4: полное уравнение с коэффициентами
В реакции окисления этилового спирта при помощи KMnO4 и H2SO4 происходит взаимодействие различных веществ, приводящее к образованию новых соединений. Уравнение окисления этилового спирта с использованием KMnO4 и H2SO4 может быть записано следующим образом:
C2H5OH + 2KMnO4 + 3H2SO4 → 2CH3COOH + 2MnSO4 + K2SO4 + 3H2O
Здесь C2H5OH обозначает молекулу этилового спирта, KMnO4 — калийный перманганат, H2SO4 — серная кислота. В результате реакции образуются уксусная кислота (CH3COOH), сульфат марганца (MnSO4), сульфат калия (K2SO4) и вода (H2O). Все коэффициенты перед веществами указывают на их соотношение в реакции. Данное уравнение является полным, так как соблюдена закономассового действия.
Окисление этилового спирта KMnO4, H2SO4

Калий перманганат (KMnO4) используется в качестве окислителя при этой реакции. Он обладает сильными окислительными свойствами и может ионизироваться в растворе, образуя MnO4- и K+ ионы. При увеличении степени окисления марганцевых ионов, окислитель переходит в Mn2+ ионы. Уравнение реакции окисления этилового спирта KMnO4 можно записать следующим образом:
CH3CH2OH + 2[O] → CH3CHO + H2O
Реакция происходит в кислой среде, поэтому используется концентрированная серная кислота (H2SO4). Серная кислота разбивается на ионы H+ и HSO4-, что создает кислую среду для протекания реакции. Она играет роль катализатора, ускоряя процесс окисления.
Уравнение реакции окисления этилового спирта KMnO4, H2SO4:
CH3CH2OH + 2H2SO4 + 2KMnO4 → CH3CHO + 2MnSO4 + K2SO4 + 3H2O
При этом, этиловый спирт (CH3CH2OH) окисляется до уксусного альдегида (CH3CHO), а калий перманганат (KMnO4) восстанавливается до сульфата марганца (MnSO4) и сульфата калия (K2SO4).
Уравнение полной реакции окисления этилового спирта KMnO4, H2SO4 позволяет нам понять, какие продукты образуются в результате исходя из начальных реагентов и условий реакции. Оно является основой для дальнейшего анализа и использования окисления этилового спирта в различных промышленных и лабораторных процессах.
Итак, окисление этилового спирта KMnO4, H2SO4 — это сложная, но увлекательная реакция, которая позволяет получить ценные органические соединения и играет важную роль в химической промышленности и научных исследованиях. Ее понимание и изучение дает нам возможность расширить наши знания о реакциях окисления и взаимодействии органических соединений в химических процессах.
Химический состав и свойства этилового спирта
Химический состав
Этиловый спирт представляет собой прозрачную и легко воспламеняющуюся жидкость без цвета и запаха. Его химическая формула CH3-CH2-OH говорит нам о его структуре — он состоит из двух углеродных атомов, пятью атомами водорода и одним атомом кислорода, связанными вместе.
Свойства
- Воспламеняемость: Этиловый спирт является легкорастворимым в воде и идеально подходит в качестве среды для различных химических реакций. Кроме того, он обладает низкой температурой вспышки, что делает его опасным в использовании.
- Антисептические свойства: Одна из самых известных и полезных особенностей этанола — его способность уничтожать микробы и бактерии. Поэтому он широко используется в медицине для дезинфекции рук и инструментов.
- Растворимость: Этиловый спирт является хорошим растворителем для многих органических соединений. Он используется в процессе выделения и очистки различных веществ, а также в производстве лаков, растворителей и парфюмерии.
- Высокая токсичность: Употребление чистого этанола может быть опасным для здоровья, поскольку он является ядовитым веществом. Поэтому этиловый спирт используется в ограниченных дозах в алкогольных напитках.
Использование этилового спирта
Этиловый спирт находит применение во многих отраслях промышленности и бытовой сфере. Некоторые из его основных применений включают:
- Производство алкогольных напитков, таких как вино и пиво.
- Использование в медицинской сфере в качестве дезинфицирующего средства.
- Производство растворителей, лаков и красок.
- Использование в парфюмерии и косметической продукции.
- Производство пищевых добавок и консервантов.
Несмотря на широкое использование и важность этилового спирта, следует помнить о его потенциальной опасности и не использовать его неадекватным образом.
Химический состав и свойства KMnO4
Свойства калия перманганата:
- Кристаллическая структура: Калий перманганат образует фиолетовые кристаллы с типичной организацией кристаллической решетки.
- Растворимость: KMnO4 легко растворяется в воде, образуя фиолетовый раствор. Однако он плохо растворяется в органических растворителях.
- Окислительные свойства: Калий перманганат является сильным окислителем. Он способен окислять многие органические и неорганические вещества.
- Стабильность: KMnO4 стабилен в условиях нормальных температур и давлений. Однако при нагревании или соприкосновении с некоторыми веществами, такими как глицерин или сахар, он может вызвать взрывоопасные реакции.
- Антибактериальные свойства: Калий перманганат обладает антибактериальными свойствами и был широко использован в медицине для обработки ран и устранения некоторых инфекций.
| Формула | KMnO4 |
|---|---|
| Молярная масса | 158,034 г/моль |
| Плотность | 2,70 г/см³ |
| Температура плавления | 240 °C |
| Температура кипения | 380 °C (разлагается) |
Таким образом, KMnO4 – это химическое соединение с уникальными свойствами, которое находит широкое применение в различных областях. Его окислительные и антибактериальные свойства делают его полезным инструментом в химическом и медицинском исследовании, а его стабильность и растворимость делают его удобным в использовании.
Химический состав и свойства H2SO4
Дорогой читатель, сегодня я хочу поговорить о H2SO4, или, если использовать его научное название, серной кислоте. Эта химическая соединение имеет множество удивительных свойств и применений, и я хотел бы поделиться с вами некоторыми из них.
Перед тем, как начать, давайте рассмотрим химический состав H2SO4. Оно состоит из двух атомов водорода (H), одного атома серы (S) и четырех атомов кислорода (O). Эти атомы соединены между собой с помощью ковалентных связей, что делает молекулу H2SO4 стабильной и стойкой.
Теперь, когда мы знаем, из чего состоит H2SO4, давайте поговорим о его свойствах. Серная кислота обладает сильно кислым вкусом и является сильным окислителем. Она также обладает высокой степенью растворимости в воде и может образовывать густые и вязкие растворы.
Одно из самых удивительных свойств H2SO4 — его реакционная способность. Она может взаимодействовать с различными веществами, образуя новые соединения. Например, при контакте с металлами (такими как цинк или железо), серная кислота может вызвать химическую реакцию, и образоваться газ водород.
Серная кислота также обладает высокой кристаллизационной температурой. Это означает, что при охлаждении она может образовывать кристаллы. Эти кристаллы могут иметь различные формы и размеры, и в зависимости от условий образования могут иметь различные свойства.
Очень важно помнить о предосторожности при работе с H2SO4. Это кислотное вещество и может вызывать ожоги или другие повреждения кожи и тканей. Поэтому необходимо соблюдать правила безопасности при работе с ним.
Процесс окисления этилового спирта KMnO4, H2SO4
Химическое уравнение
Уравнение этой реакции можно представить следующим образом:
CH3CH2OH + 2KMnO4 + 8H2SO4 → 2CH3COOH + 2K2SO4 + 2MnSO4 + 8H2O
Подробнее рассмотрим каждый компонент этого химического уравнения:
- CH3CH2OH — это структурная формула этилового спирта, который является простейшим спиртом и широко используется в промышленности и медицине.
- 2KMnO4 — две молекулы калия перманганата. Калий перманганат является сильным окислителем и широко применяется в химических исследованиях.
- 8H2SO4 — восемь молекул серной кислоты. Серная кислота играет роль катализатора при этой реакции и ускоряет процесс окисления.
- 2CH3COOH — две молекулы уксусной кислоты. Уксусная кислота является конечным продуктом этой реакции.
- 2K2SO4 — две молекулы сульфата калия. Сульфат калия образуется в результате реакции между калием перманганатом и серной кислотой.
- 2MnSO4 — две молекулы сульфата марганца. Сульфат марганца образуется в результате окисления марганцем в составе калия перманганата.
- 8H2O — восемь молекул воды. Вода образуется в результате реакции между калием перманганатом и серной кислотой.
Описание процесса
Когда этиловый спирт (CH3CH2OH) вступает в реакцию с калием перманганатом (KMnO4) и серной кислотой (H2SO4), происходит окисление органического соединения. Калий перманганат в разбавленной серной кислоте действует как сильный окислитель, отбирая электроны у этилового спирта и превращаясь в сульфат марганца (MnSO4).
В результате этой реакции образуются уксусная кислота (CH3COOH), сульфат калия (K2SO4), сульфат марганца (MnSO4) и вода (H2O). Уксусная кислота является конечным продуктом реакции и имеет много применений в различных отраслях промышленности.
Этот процесс окисления этилового спирта KMnO4, H2SO4 можно использовать для идентификации этанола (этилового спирта) в химических анализах или для производства уксусной кислоты.
Таким образом, процесс окисления этилового спирта KMnO4, H2SO4 — это химическая реакция, которая является важным объектом исследований и имеет практическое значение в различных сферах науки и промышленности.
Полное уравнение окисления этилового спирта KMnO4, H2SO4
Уравнение окисления этилового спирта с использованием дихромата калия (KMnO4) и серной кислоты (H2SO4) может быть представлено следующим образом:
CH3CH2OH + 2KMnO4 + 3H2SO4 → 2CH3COOH + 2MnSO4 + K2SO4 + 3H2O
В этом уравнении этиловый спирт (C2H5OH) окисляется до уксусной кислоты (CH3COOH). Калий перманганат (KMnO4) и серная кислота (H2SO4) используются в качестве окислителя и катализатора соответственно.
В результате окисления этилового спирта происходит образование двух молекул уксусной кислоты, двух молекул сульфата марганца (II), одной молекулы сульфата калия и трех молекул воды.
Уравнение показывает, что этиловый спирт подвергается окислению, теряя водородные атомы, в то время как калий перманганат выполняет функцию окислителя, принимая эти водородные атомы.
Это уравнение является полным, поскольку отображает все вещества, участвующие в реакции, а также их коэффициенты. Также можно заметить, что коэффициенты уравнения сбалансированы, что обеспечивает закон сохранения массы и заряда в реакции.
Важно отметить, что уравнение окисления этилового спирта KMnO4, H2SO4 является упрощенной моделью, которая не учитывает все возможные побочные реакции и условия эксперимента. В реальных условиях окисления этилового спирта могут происходить и другие химические реакции, и процесс может быть более сложным.
Тем не менее, данное уравнение является хорошим примером для иллюстрации процесса окисления этилового спирта с использованием дихромата калия и серной кислоты.
Зависимость процесса окисления от коэффициентов
При изучении процессов окисления и восстановления в химии важную роль играют коэффициенты уравнения. Правильное задание коэффициентов в уравнении окисления позволяет определить соотношение между реагентами и продуктами, а также выявить изменение степени окисления атомов и их количественное соотношение.
Коэффициенты в уравнении окисления являются числовыми множителями, устанавливающими соотношение количества веществ входящих в реакцию. Они определяют количество молей вещества, необходимого для окисления или восстановления одного моля другого вещества.
Правильное определение коэффициентов в уравнении окисления позволяет соблюдать законы сохранения массы и заряда. Коэффициенты помогают выявить изменение степени окисления атомов, которое характеризует потерю или приобретение электронов в ходе окислительно-восстановительной реакции.
Правильно поставленные коэффициенты позволяют также определить количество реагентов, необходимое для проведения реакции, и количество продуктов, получаемых в результате. Важно отметить, что коэффициенты в уравнении окисления являются относительными, то есть устанавливают только пропорции между веществами.






