
Степень окисления вещества CuNO32 — одна из ключевых характеристик, определяющих его химические свойства и реактивность. На основе наблюдений и экспериментов было установлено, что степень окисления ионов меди (Cu) в CuNO32 равна +2. Это означает, что каждый ион меди в этом соединении имеет две потерянных электронных заряда. Благодаря данной информации можно более точно предсказать химические реакции и взаимодействия CuNO32 с другими веществами. Важно отметить, что степень окисления может изменяться в зависимости от условий реакции и реагентов, но в данном случае мы рассматриваем стандартное состояние CuNO32. Анализ и объяснение степени окисления вещества CuNO32 помогает углубить понимание его химических свойств и применения в различных областях науки и промышленности.
Определение степени окисления
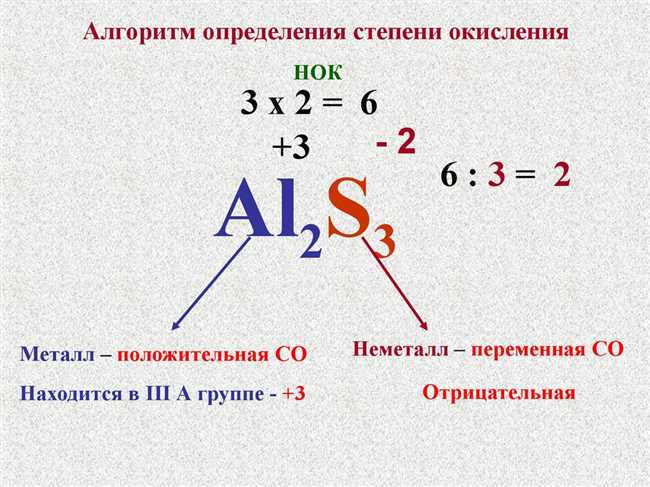
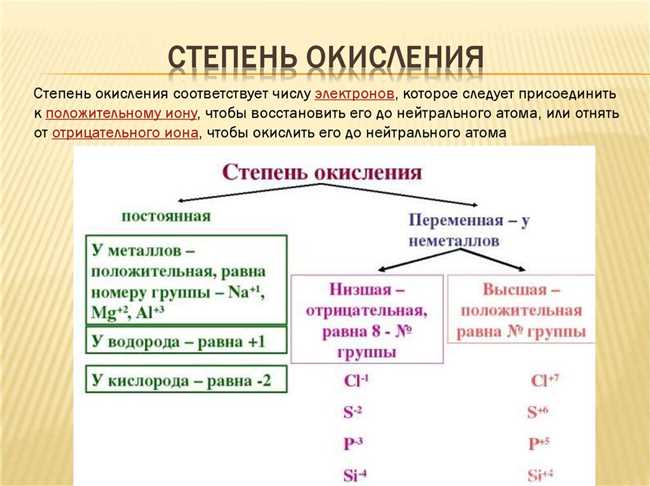
Установление степени окисления атома вещества может быть несколько сложным заданием, но определение степени окисления является важным шагом в понимании его химических свойств и участия в реакциях. Все атомы имеют степень окисления, она может быть положительной или отрицательной, а также нулевой, что означает, что атом не подвергается окислению или восстановлению.
Для определения степени окисления атома вещества можно использовать следующие правила:
- Степень окисления свободного элемента всегда равна нулю. Например, атом кислорода в молекуле O₂ имеет степень окисления 0.
- Степень окисления простого иона равна заряду иона. Например, степень окисления иона калия K⁺ равна +1, а степень окисления иона кислорода в ионе супероксида O₂⁻ -1.
- В двухатомных молекулах алканов степень окисления водорода равна +1, а атома более электроотрицательного элемента -1.
- Степень окисления кислорода обычно равна -2, за исключением пероксидов, где она равна -1, и у фтора, где она равна +2.
- Степень окисления водорода обычно равна +1, за исключением металлических гидридов, где она равна -1.
- Степень окисления щелочного металла (например, Na, K) обычно равна +1, щелочноземельного металла (например, Mg, Ca) — +2, а аллюминия — +3.
Используя эти правила, можно определить степень окисления атома вещества и легко расшифровать его участие в химической реакции или соединении. Понимание степени окисления поможет вам углубиться в изучение химии и лучше понять химические процессы, происходящие вокруг нас.
Состав и свойства вещества Cu(NO3)2

Давайте разберемся, что такое вещество Cu(NO3)2. Как вы уже знаете по формуле, вещество состоит из атомов меди (Cu) и атомов азота (N), связанных с кислородом (O) и образующих группу нитратов (NO3).
Важно отметить, что медь в этом соединении имеет степень окисления +2. Это означает, что атом меди потерял два электрона и приобрел положительный заряд. Атомы азота в нитратной группе имеют степень окисления +5, а атомы кислорода –2.
Теперь давайте рассмотрим некоторые основные свойства вещества Cu(NO3)2:
1. Растворимость
Вещество Cu(NO3)2 отлично растворяется в воде. Это означает, что при контакте с водой его молекулы или ионы полностью разбиваются на составляющие и смешиваются с водными молекулами. Такой раствор называется аммиачной медью и он имеет голубой цвет.
2. Физические свойства
Вещество Cu(NO3)2 представляет собой кристаллы, имеющие голубой цвет. Эти кристаллы обладают хорошей устойчивостью к давлению и высоким температурам.
3. Химические свойства
Когда вещество Cu(NO3)2 подвергается нагреванию, оно распадается на оксид меди (CuO), оксид азота (NO2) и кислород (O2). Этот процесс называется термическим разложением.
Вещество Cu(NO3)2 также действует как окислитель во многих химических реакциях, то есть способствует передаче электронов от одного вещества к другому. Например, оно может окислять металлы, такие как цинк (Zn), и образовывать ион меди (Cu2+).
Таким образом, вещество Cu(NO3)2, состоящее из атомов меди, азота и кислорода, является растворимым в воде и обладает различными физическими и химическими свойствами.
Расчет степени окисления вещества Cu(NO3)2
Когда речь идет о расчете степени окисления вещества Cu(NO3)2, мы должны учесть два фактора: степень окисления металла меди (Cu) и степень окисления антиона нитрата (NO3).
Чтобы определить степень окисления металла, нам нужно знать его заряд. Для ионов меди в ее соединениях заряд может быть различным. В данном случае мы имеем Cu(NO3)2, что означает, что ион меди имеет заряд 2+. Ион нитрата (NO3) имеет заряд 1-, что является универсальным для всех нитратов.
Теперь, чтобы вычислить степень окисления, нам нужно узнать, сколько электронов переходит с меди на антион нитрата. Зная, что Cu(NO3)2 имеет общую зарядность 0, и общая зарядность соединения формируется путем сложения зарядов всех его компонентов, мы можем сделать следующее:
| Компонент | Заряд | Количество | Сумма зарядов |
|---|---|---|---|
| Cu | +2 | 1 | +2 |
| NO3 | -1 | 2 | -2 |
Итак, мы имеем +2 (от меди) и -2 (от нитратов), и эти заряды компенсируют друг друга, образуя общую зарядность 0 для Cu(NO3)2. Таким образом, степень окисления меди (Cu) в этом соединении равна +2.
Теперь давайте посмотрим на степень окисления антиона нитрата (NO3). В нитрате азотничный ион имеет степень окисления +5, поскольку к нему прикреплены три кислородных атома, которые имеют степень окисления -2, и зарядное состояние нитратного иона в целом равно -1. Таким образом, степень окисления антиона нитрата в Cu(NO3)2 также равна -1.
Итак, чтобы резюмировать, степень окисления меди в веществе Cu(NO3)2 равна +2, а степень окисления антиона нитрата равна -1.
Надеюсь, это помогло вам лучше понять, какой расчет выполняется при определении степени окисления вещества Cu(NO3)2. Если у вас остались вопросы, не стесняйтесь задавать их!
Влияние степени окисления на свойства вещества Cu(NO3)2
Степень окисления имеет важное влияние на химические и физические свойства вещества Cu(NO3)2:
- Растворимость: Степень окисления меди в Cu(NO3)2 обуславливает высокую растворимость этого соединения в воде. Присутствие положительного заряда на ионе меди (+2) делает его привлекательным для отрицательно заряженных растворителя (воды) и способствует диссоциации соединения на ионы Cu2+ и NO3-. Таким образом, Cu(NO3)2 образует стабильные и хорошо растворимые растворы в воде.
- Электрохимические свойства: Степень окисления меди в Cu(NO3)2 также влияет на его электрохимические свойства. Заряд на ионе Cu2+ делает его способным к и данный ион с легкостью реагирует с другими веществами в электрохимических процессах, таких как окислительно-восстановительные реакции.
- Цветность: Медь в соединении Cu(NO3)2 обладает довольно ярким голубым цветом. Степень окисления меди в этом соединении определяет спектр поглощения и выброса света, что в конечном итоге определяет его цветовые свойства.
- Кристаллическая структура: Степень окисления азота в Cu(NO3)2 влияет на кристаллическую структуру данного соединения. Соль меди и азотной кислоты образует кристаллы, в которых соединены катионы меди и анионы нитратных групп NO3-. Степень окисления азота определяет конфигурацию и упорядоченность этих кристаллов.
Итак, степень окисления играет важную роль в определении свойств вещества Cu(NO3)2. Она влияет на его растворимость, электрохимические свойства, цветность и кристаллическую структуру. Понимание этих свойств помогает лучше понять химическую природу данного соединения и эффективно использовать его в различных областях, таких как химическая промышленность, медицина и технологии.
Примеры использования вещества CuNO32 с разными степенями окисления
В зависимости от степени окисления меди, CuNO32 может использоваться в различных областях и иметь разнообразные свойства:
- Катализатор в органическом синтезе: Медь в степени окисления +2 может использоваться как катализатор в различных органических реакциях, таких как окисление алканов, алифатических аминов и спиртов. Купрат(II) нитрат может служить источником катиона меди в таких катализаторах.
- Красители и красители для стекла: Медь со степенью окисления +2 может образовывать различные окраски и использоваться в производстве красителей и красавиц для стекла.
- Электролит в электрохимических процессах: Купрат(II) нитрат может использоваться в качестве электролита в электрохимических ячейках и батареях. Это связано с тем, что ионы меди (Cu2+) могут участвовать в электрохимических реакциях и обеспечивать перенос зарядов.






