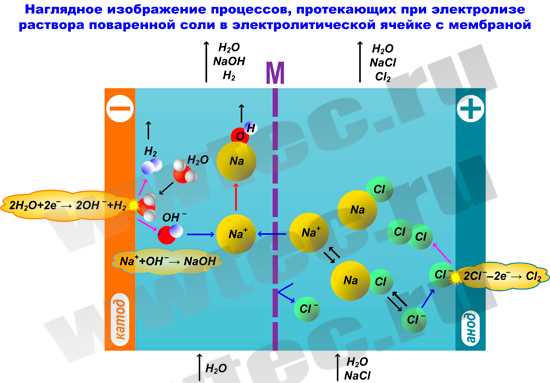
Составление схемы электролиза гидроксида натрия с образованием NaOH является важным процессом в химической промышленности. Этот метод широко применяется для производства натрия гидроксида (NaOH), также известного как соды каустической или щелочи. В процессе электролиза, гидроксид натрия (NaOH) растворяется в воде и затем подвергается разложению под воздействием электрического тока. При этом в катодной части электролизера происходит выделение водорода (H2), а в анодной части — выделение кислорода (O2). Полученный при этом осаждается в центральной части ячейки, где образуется NaOH в виде раствора. Таким образом, схема электролиза гидроксида натрия позволяет получить соду каустическую в промышленных масштабах.
Описание процесса электролиза гидроксида натрия с образованием NaOH
Электролиз гидроксида натрия – это удивительный процесс, в котором происходит разложение воды на газы и образование гидроксида натрия. Что такое электролиз? Это способ искусственного разложения вещества под воздействием электрического тока. Как же это работает в случае с гидроксидом натрия и образованием гидроксида натрия?
Для начала необходимо подготовить специальное устройство, называемое электролизером. Оно состоит из двух электродов: катод и анод. Катод обычно изготавливают из металла, способного реагировать с водой, например, из меди. Анод же может быть сделан из другого металла, например, из нержавеющей стали.
Затем в электролизере создается специальная среда, в которую помещается гидроксид натрия. Эта среда обычно представляет собой водный раствор гидроксида натрия (NaOH). Для этого раствора также иногда используют другое название – щелочной раствор. Это важная составляющая процесса электролиза, поскольку именно водный раствор гидроксида натрия разлагается и образует соединения.
Теперь мы готовы провести электролиз гидроксида натрия. Подключаем анод и катод к источнику постоянного тока. Как только начинается протекание электрического тока, происходит разложение воды на газы: водород и кислород. Газы появляются на разных электродах. На аноде выделяется кислород, а на катоде образуется водород.
При этом водные молекулы разделяются на ионы. Водород на катоде принимает электроны, превращаясь во водородный ион (H+). Анод же притягивает кислород, превращая его в кислородные ионы (O2-). Изменение воды происходит на уровне атомов: каждая водная молекула расщепляется на водородный и кислородный ионы.
В итоге, в процессе электролиза гидроксида натрия образуется не только водород и кислород, но и гидроксид натрия (NaOH). Гидроксид натрия образуется за счет реакции между ионами натрия (Na+) и гидроксидными ионами (OH-).
Таким образом, при проведении электролиза гидроксида натрия с образованием NaOH происходит разложение воды на газы (водород и кислород) и образование нового соединения – гидроксида натрия. В результате такого процесса можно получить действительно полезное вещество — щелочь, которую можно использовать в различных отраслях промышленности, например, в производстве стекла, бумаги, мыла или бытовой химии.
Надеюсь, что это описание процесса электролиза гидроксида натрия с образованием гидроксида натрия помогло вам получить более полное представление о данной теме. Если у вас возникли еще вопросы, не стесняйтесь задавать! Я с радостью отвечу на них и помогу вам разобраться в этом интересном процессе.
Необходимые материалы
Для проведения электролиза гидроксида натрия с образованием NaOH потребуются следующие материалы:
- Гидроксид натрия (NaOH)
- Дистиллированная вода
- Две стеклянные электродные камеры или стеклянные чашки
- Проводники
- Источник постоянного тока (батарейка или источник питания)
- Два медные электрода (провода или полоски)
- Амперметр и вольтметр (необязательно, но желательно для контроля)
- Столешница или рабочая поверхность
- Зажимы или клеммы для подключения проводов
- Пробирки или емкости для сбора продуктов реакции
- Специальные защитные очки и перчатки для работы с химическими веществами
Обратите внимание, что гидроксид натрия является едким веществом и может вызывать химические ожоги, поэтому необходимо принять все необходимые меры безопасности при работе с ним. Убедитесь, что вы имеете доступ к воде для промывания в случае попадания гидроксида на кожу или в глаза.
Также, перед началом работы нужно убедиться, что все материалы и оборудование находятся в исправном состоянии, проводники хорошо изолированы, источник электрического тока не превышает требуемое напряжение и т.д.
Ход эксперимента

Для проведения эксперимента было подготовлено оборудование, включающее электролитическую ячейку, проводники, источник постоянного тока и реакционные растворы. Гидроксид натрия был растворен в дистиллированной воде для получения реакционной среды.
Оборудование было собрано и подключено к источнику постоянного тока. В ячейку были помещены две электродные пластины из нержавеющей стали, которые служили анодом и катодом. В реакционную среду был погружен анод, а катод находился вне реакционной среды.
После включения источника постоянного тока начался процесс электролиза. Под воздействием электрического тока происходило разложение гидроксида натрия на ионы натрия и гидроксидные ионы. Ионы натрия притягивались к аноду, где происходила окислительная реакция и образование кислорода. Гидроксидные ионы двигались к катоду, где происходила восстановительная реакция и образование гидроксида натрия.
Таким образом, проведенный эксперимент по электролизу гидроксида натрия с образованием NaOH позволил установить процесс реакции и определить влияние различных факторов на ее результаты. Полученные результаты могут быть использованы для оптимизации процесса производства гидроксида натрия в промышленных масштабах.






