- Металлы, относящиеся к щелочным
- Что такое щелочные металлы и чем они отличаются?
- Свойства и химическая реактивность щелочных металлов
- 1. Активность и реакция с кислородом
- 2. Реакция с водой
- 3. Высокая электроотрицательность
- 4. Самозажигание реакции с кислородом
- 5. Формирование солей
- 6. Значение в нашей жизни
- Примеры щелочных металлов
- Заключение
- Почему щелочные металлы относятся к этой группе?

Какие металлы относят к щелочным и почему?
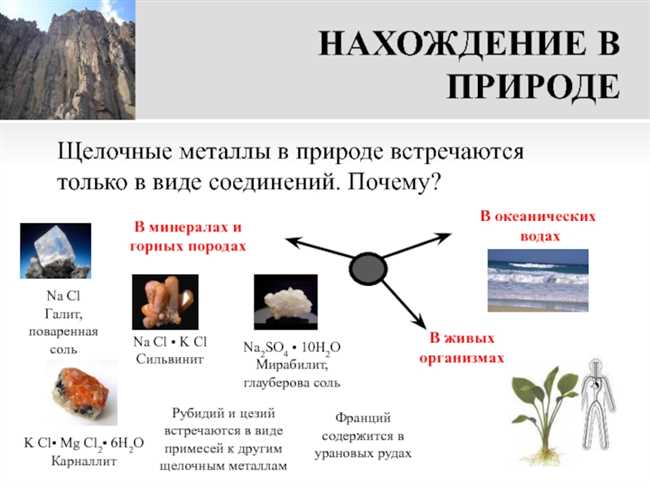
Щелочные металлы — это одна из основных групп элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Почему именно эти элементы относят к щелочным?
Одной из основных причин является их положение в таблице химических элементов — они располагаются в первой группе между щелочными землями и переходными металлами. Щелочные металлы характеризуются химическими свойствами, которые делают их реакционноспособными и реактивными, особенно при контакте с водой.
Важным фактором является также электронная конфигурация щелочных металлов. Они имеют всего один электрон в своей внешней электронной оболочке, что делает их склонными к потере электрона и образованию катионов, что способствует их реактивности.
Кроме того, щелочные металлы имеют низкую электронную аффинность и ионизационный потенциал, что означает их склонность к образованию положительных ионов, а также способность реагировать с другими веществами и соединениями.
Итак, кратко: щелочные металлы относят к щелочным из-за своей групповой принадлежности в таблице химических элементов, их электронной конфигурации и химических свойств, которые делают их реакционноспособными.
Металлы, относящиеся к щелочным
Они названы «щелочными» из-за своей способности образовывать гидроксиды щелочного характера (щелочи), когда они взаимодействуют с водой. Например, когда кусочек натрия или калия погружают в воду, наблюдается бурная реакция, поскольку образуется щелочь и выделяется водородный газ. Именно эта реакция была замечена первым исследователем щелочных металлов, Александром Гудино (А.Гудино).
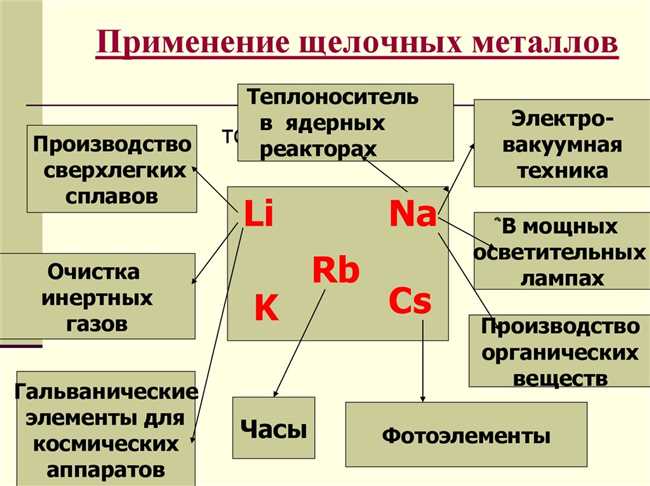
Другой особенностью щелочных металлов является их низкая плотность. Например, литий является самым легким металлом и имеет плотность примерно в два раза меньше, чем у воды. Это делает их полезными во многих приложениях, включая аккумуляторы.
Щелочные металлы обладают также хорошей электропроводностью, что делает их полезными для использования в электрических цепях и проводах. Они также мягкие и легко формируемые, что делает их пригодными для использования в изготовлении различных изделий, таких как листы и фольга. Калий, например, используется в удобрениях для повышения плодородия почвы, а натрий широко используется в пищевой промышленности.
Итак, металлы, относящиеся к щелочным, обладают рядом уникальных свойств, которые делают их важными в практическом применении. Их реактивность, низкая плотность, хорошая электропроводность и легкая формируемость делают их полезными в различных отраслях, от энергетики до производства пищевых продуктов. Щелочные металлы — это не просто химические элементы, они играют жизненно важную роль в современном обществе.
Что такое щелочные металлы и чем они отличаются?
Эти металлы отличаются от других металлов своими уникальными свойствами и реакционной способностью:
- Мягкость и низкая плотность: Щелочные металлы являются мягкими и легкими веществами. Например, кусочек калия может быть растертым пальцами.
- Активность: Щелочные металлы очень реактивны и быстро окисляются в контакте с воздухом и водой. Это делает их яркими искрами при взаимодействии с воздухом.
- Низкая плотность плавления: Щелочные металлы также обладают низкими температурами плавления, что делает их идеальными для использования в различных промышленных процессах.
- Более низкая ионизационная энергия: Эти металлы имеют меньшую энергию, необходимую для удаления электрона. Из-за этого они образуют положительные ионы (катионы) и легко образуют ионные связи с отрицательно заряженными атомами или группами атомов.
Кроме того, щелочные металлы имеют большой потенциал для использования в различных областях науки и технологий, таких как электрохимия, энергетика, фармацевтика и другие.Итак, щелочные металлы — это уникальные элементы, обладающие особыми свойствами и широким спектром применения. Их химическая активность и способность образовывать щелочные растворы делают их неотъемлемой частью химической и научной области.
Свойства и химическая реактивность щелочных металлов
1. Активность и реакция с кислородом
Щелочные металлы очень активны и легко реагируют с кислородом. Если свежесрезанные или очищенные поверхности этих металлов оставить на воздухе, они быстро окислятся и образуют покрытие оксида. Например, натрий мгновенно становится серым, а калий приобретает сероватый цвет. Это из-за их высокой реактивности и склонности к образованию оксидов они хранятся внутри масла или в инертной среде, чтобы предотвратить контакт с влагой и кислородом.
2. Реакция с водой
Одним из самых характерных свойств щелочных металлов является их реакция с водой. При контакте с водой они образуют щелочные растворы и выделяются гидроген. Литий, например, реагирует медленно с водой, образуя гидроксид лития и выделяясь водородный газ. С ростом размера атомов в группе, скорость реакции с водой увеличивается. Калий, рубидий и цезий реагируют с водой гораздо более активно, некоторые из них сопровождаются вспышками и искрами.
3. Высокая электроотрицательность
Щелочные металлы обладают высокой электроотрицательностью, что делает их главными электронными донорами. Это означает, что они легко отдают свои внешние электроны во время химических реакций. В результате этих реакций щелочные металлы образуют ионы с положительным зарядом. Например, ион натрия Na+ образуется при окислении натрия.
4. Самозажигание реакции с кислородом

Еще одна интересная характеристика щелочных металлов – их способность к самозажиганию в присутствии кислорода и влаги. Например, калий может самозагораться, если на него небрежно попадет вода или влага из воздуха. Это связано с тем, что при реакции с кислородом щелочные металлы вырабатывают достаточно тепла, чтобы воспламеняться. Поэтому для безопасного хранения, перевозки и использования они должны быть защищены от воздуха и влаги.
5. Формирование солей
Щелочные металлы образуют щелочные растворы, которые могут быть использованы для формирования различных солей. Например, гидроксид натрия NaOH, щелочное соединение, может использоваться для получения натрийсолей различных органических и неорганических кислот. Это делает щелочные металлы важными в химической промышленности и в процессах синтеза различных соединений.
6. Значение в нашей жизни
Щелочные металлы обладают рядом свойств, которые делают их незаменимыми в нашей жизни. Например, натрий используется в пищевой промышленности для приправ и консервирования, калий важен для здоровья человека и находит широкое применение в медицине. Кроме того, щелочные металлы играют важную роль в производстве стекла, мыла, батареек и многих других материалов и продуктов.
Итак, свойства и химическая реактивность щелочных металлов делают их уникальными и полезными. Их активность, способность реагировать с кислородом и водой, высокая электроотрицательность, самозажигание реакции, а также способность образовывать соли отличает их от других элементов. Знание и понимание этих свойств помогает нам использовать щелочные металлы в различных отраслях нашей жизни и делает их неотъемлемой частью нашего существования.
Примеры щелочных металлов
Вот некоторые примеры щелочных металлов:
-
Литий (Li) — это наименьший и наиболее легкий из щелочных металлов. Он имеет серебристо-белый цвет и используется в различных областях, включая производство легких сплавов и лекарственных препаратов.
-
Натрий (Na) — в отличие от лития, натрий имеет яркий желтый цвет. Он широко используется в пищевой промышленности для консервирования и придания вкуса пище.
-
Калий (K) — калий также имеет яркий желтый цвет и обладает большими практическими применениями. Он используется в производстве удобрений, стекла и мыла, а также в медицинских препаратах.
-
Рубидий (Rb) — рубидий имеет серебристо-белый цвет, похожий на литий. Он часто применяется в исследованиях атомной физики и масс-спектрометрии.
-
Цезий (Cs) — цезий является самым реактивным из всех щелочных металлов. Он наиболее известен своим использованием в атомных часах и электронике.
Все эти металлы имеют схожие химические свойства, такие как низкую электроотрицательность и склонность образовывать ионы с положительным зарядом. Они также являются отличными проводниками тепла и электричества.
Заключение
Щелочные металлы — это интересная группа элементов с уникальными свойствами. Литий, натрий, калий, рубидий и цезий — это всего лишь некоторые примеры щелочных металлов, которые широко используются в различных отраслях науки и промышленности.
Почему щелочные металлы относятся к этой группе?
Щелочные металлы обладают рядом характеристических свойств, которые объединяют их в эту группу.
- Электроотрицательность: Щелочные металлы имеют очень низкую электроотрицательность, что означает, что они обладают большой склонностью отдавать электроны. Это связано с тем, что у них нарушенный электронный барьер между последним заполненным энергетическим уровнем и следующим.
- Отдача электронов: Щелочные металлы легко отдают внешний электрон, что делает их очень реактивными. Отдача электронов позволяет им формировать ионы с положительным зарядом (катионы).
- Связь с водой: Щелочные металлы реагируют с водой, образуя гидроксиды щелочных металлов и выделяя водород. Этот процесс называется гидролизом.
- Свойства оксида: Щелочные металлы образуют щелочные оксиды, которые растворяются в воде, образуя щелочные растворы.
- Образование солей: Щелочные металлы способны образовывать многочисленные соли с кислотами. Образование солей является одним из основных химических свойств щелочных металлов.
Благодаря всем этим свойствам, щелочные металлы образуют единую группу, которую принято называть щелочными металлами. Они широко используются в различных областях, включая производство сплавов, производство щелочей и реагентов, а также в батареях и электронике.






