- Описание схемы электролиза раствора нитрата меди II
- Шаг 1: Подготовка позолоченного катода и платинового анода
- Шаг 2: Погружение электродов в раствор нитрата меди II
- Шаг 3: Подключение внешнего источника тока
- Шаг 4: Наблюдение за процессом электролиза
- Шаг 1: Приготовление раствора нитрата меди II
- Шаг 2: Подготовка электролизной ячейки
- Шаг 3: Регулировка параметров электролиза
- Шаг 4: Проведение электролиза
- Шаг 5: Анализ полученных результатов

Схема электролиза раствора нитрата меди II: шаг за шагом
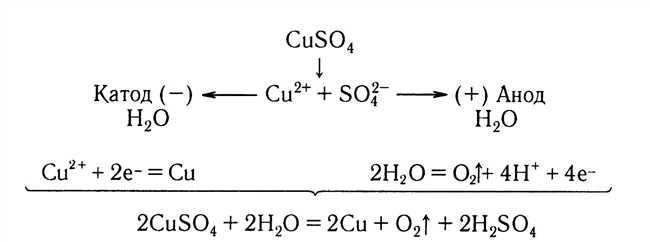
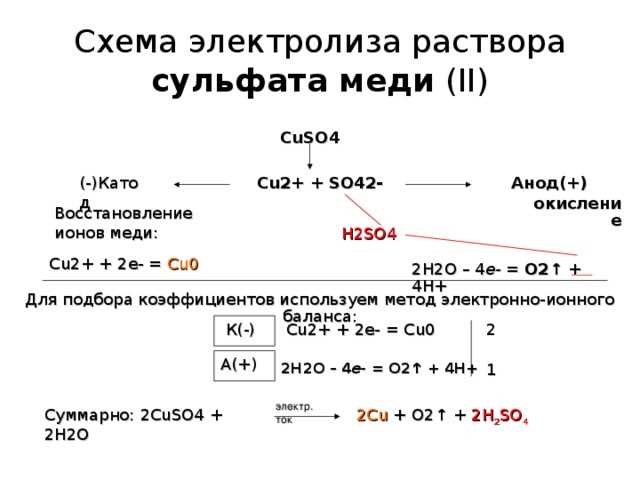
Процесс электролиза раствора нитрата меди II – это химическая реакция, при которой с помощью электрического тока разлагается раствор нитрата меди II на элементы медь и кислород. Электролиз проводится с помощью электролитической ячейки, в которой находятся анод и катод – два электрода. Анодом обычно является пластина из меди, а катодом – пластина из инертного материала, например, платины. В начале процесса раствор нитрата меди II находится между электродами, и при подаче электрического тока происходит окисление меди на аноде и одновременное восстановление кислорода на катоде. Шаг за шагом, медь постепенно осаждается на катоде, а кислород выделяется на аноде. Таким образом, электролиз раствора нитрата меди II проходит по определенной схеме, которая позволяет получить медную пленку на поверхности катода.
Описание схемы электролиза раствора нитрата меди II

Перед тем, как мы погрузимся в схему электролиза раствора нитрата меди II, давайте разберемся, что вообще это за реакция и зачем она важна. Нитрат меди II — это химическое вещество, состоящее из ионов меди и нитратных ионов. Этот раствор способен проводить электрический ток, и это даёт нам возможность провести электролиз.
Шаг 1: Подготовка позолоченного катода и платинового анода
Для начала, нам понадобятся два электрода — позолоченный катод и платиновый анод. Позолоченный катод представляет собой медный электрод с тонким слоем золота на поверхности. Платиновый анод — это просто покрытый платиной электрод. Использование этих электродов обеспечивает хорошую проводимость и повышает эффективность самого процесса электролиза.
Шаг 2: Погружение электродов в раствор нитрата меди II
После того, как у нас есть подготовленные электроды, мы опускаем их в раствор нитрата меди II. Обратите внимание, что катод и анод должны быть разделены, чтобы предотвратить случайные реакции между ними. Таким образом, расстояние между ними должно быть достаточным. Это позволит нам точно контролировать реакцию электролиза.
Шаг 3: Подключение внешнего источника тока
Теперь самое время подключить внешний источник тока. Мы используем источник постоянного тока (например, батарею или аккумулятор) для создания потенциала между электродами. Это приведет к электролизу раствора нитрата меди II.
Шаг 4: Наблюдение за процессом электролиза
По мере прохождения электрического тока через раствор нитрата меди II, начинается реакция электролиза. На катоде, медные ионы получают электроны и превращаются в чистую медь, которая образует отложение на поверхности катода. На аноде, водные молекулы окисляются и выделяются кислород и водород.
Важно отметить, что процесс электролиза является реверсивной реакцией, то есть мы можем менять направление потока электрического тока и тем самым изменять направление реакции. Это делает процесс электролиза раствора нитрата меди II очень гибким и полезным для различных химических исследований и применений.
Таким образом, схема электролиза раствора нитрата меди II — это процесс, который позволяет нам изучать реакцию электролиза, а также получать медь и различные продукты реакции. Что вы думаете о таком типе реакции? Был ли у вас опыт проведения электролиза или знакомства с ним? Если да, то с каким результатом? Расскажите о своем опыте, мне будет интересно услышать вашу историю!
Шаг 1: Приготовление раствора нитрата меди II
Перед тем, как мы начнем процесс электролиза, первым шагом будет приготовление раствора нитрата меди II. Этот раствор будет нашей основной средой для проведения электролиза.
Хорошей новостью является то, что приготовление раствора нитрата меди II довольно простое и требует всего нескольких ингредиентов. Для этого нам понадобится:
- Медный оксид (CuO)
- Кислородная кислота (HNO3)
- Дистиллированная вода (H2O)
Важно отметить, что при работе с кислотой необходимы соответствующие меры предосторожности, такие как защитные перчатки и очки.
Теперь перейдем к процессу приготовления раствора нитрата меди II:
- Возьмите небольшое количество медного оксида (CuO) и поместите его в стеклянную или пластиковую посуду.
- Добавьте некоторое количество кислородной кислоты (HNO3) к медному оксиду. Обратите внимание, что при реакции возникнет фиолетовая дымка — это азотная кислота.
- Тщательно перемешайте смесь до тех пор, пока медный оксид не растворится полностью.
- После полного растворения медного оксида медленно добавьте дистиллированную воду (H2O) для разбавления раствора.
- Продолжайте перемешивать раствор, чтобы достичь равномерности.
- Оцените концентрацию раствора и, если необходимо, добавьте небольшое количество дополнительной кислородной кислоты или дистиллированной воды для достижения желаемой консистенции.
Теперь у вас есть готовый раствор нитрата меди II! Он готов к использованию в следующем шаге электролиза.
Итак, мы успешно справились с первым шагом процесса электролиза – приготовлением раствора нитрата меди II. Вы готовы перейти к следующему шагу, где мы начнем проведение самого электролиза. Убедитесь, что у вас есть все необходимые ингредиенты и приспособления перед тем, как приступать к следующему этапу. Удачи!
Шаг 2: Подготовка электролизной ячейки
Теперь, когда мы разобрались с необходимыми принципами и механизмами процесса электролиза раствора нитрата меди II, давайте перейдем к подготовке электролизной ячейки. Этот шаг крайне важен, так что внимательно следуйте инструкции.
Первым шагом подготовки ячейки является выбор подходящего контейнера. Рекомендуется использовать стеклянный или пластиковый контейнер, который может вместить раствор нитрата меди II и два электрода. Убедитесь, что контейнер чистый и сухой, чтобы избежать нежелательных реакций или загрязнений.
Далее, нужно подготовить два электрода — анод и катод. Анод должен быть сделан из материала, который не реагирует с раствором нитрата меди II и не окисляется во время процесса электролиза. Отличным вариантом является платиновый электрод. Катод, в свою очередь, должен быть сделан из меди, чтобы проходила реакция осаждения меди на поверхности катода.
Поместите выбранные электроды в контейнер таким образом, чтобы они были параллельны друг другу и находились на небольшом расстоянии друг от друга. Важно обеспечить, чтобы электроды не соприкасались друг с другом, чтобы предотвратить короткое замыкание.
Каждый электрод должен быть подключен к источнику электрического тока, такому как батарея или источник постоянного тока. Обратите внимание на правильную полярность — анод должен быть подключен к положительному полюсу, а катод к отрицательному полюсу.
Наконец, заполните контейнер раствором нитрата меди II. Раствор можно приготовить самостоятельно, добавив определенное количество нитрата меди II в дистиллированную воду. Убедитесь, что раствор полностью растворен и однороден.
Теперь, когда ваша электролизная ячейка полностью подготовлена, вы готовы к следующему шагу — запуску электролиза раствора нитрата меди II. Но об этом мы расскажем на следующем этапе.
Шаг 3: Регулировка параметров электролиза
Теперь, когда мы установили надлежащую схему электролиза раствора нитрата меди II, пришло время регулировать несколько важных параметров. Это поможет нам достичь оптимальных результатов и получить желаемые продукты электролиза.
Первым параметром, который следует регулировать, является ток электролиза. Он определяет скорость процесса и влияет на количество выделяемого металла. Для достижения наилучших результатов рекомендуется использовать постоянный ток с интенсивностью, подобранной опытным путем. Слишком высокий ток может вызвать нежелательные побочные эффекты, в то время как слишком низкий ток может привести к недостаточному образованию меди.
Вторым параметром является время электролиза. Оно определяет продолжительность процесса и тоже влияет на количество выделяемого металла. Оптимальное время электролиза зависит от интенсивности тока и желаемого количества меди. Чем дольше процесс, тем больше меди будет выделено, но при этом растет риск нежелательных побочных реакций.
Третьим параметром является концентрация раствора нитрата меди II. Она также влияет на скорость процесса и количество получаемого металла. Высокая концентрация раствора может привести к увеличению скорости электролиза, но повышает риск побочных реакций. Низкая концентрация может замедлить процесс, но снизить вероятность побочных эффектов.
Дополнительные параметры, которые можно регулировать, включают температуру раствора и режим перемешивания. В некоторых случаях, изменение этих параметров может улучшить эффективность электролиза и повысить выход меди.
Итак, регулировка параметров электролиза является ключевым шагом для достижения желаемых результатов. Опыт и практика помогут вам найти оптимальные значения каждого параметра в вашей конкретной ситуации. Не бойтесь экспериментировать и задавать вопросы, чтобы достичь наилучших результатов!
Шаг 4: Проведение электролиза
Пришло время провести сам электролиз. Это захватывающий этап, на котором мы будем применять электрический ток к раствору нитрата меди II и наблюдать, как происходят химические изменения.
Для начала, убедитесь, что все необходимые приборы и материалы подготовлены на рабочей поверхности. Вам понадобятся:
- Источник электрического тока, такой как батарея или блок питания;
- Два электрода — положительный (анод) и отрицательный (катод), которые будут погружены в раствор;
- Раствор нитрата меди II;
- Клеммы или провода для подключения электродов к источнику тока.
Теперь проведите следующие шаги:
- Включите источник тока и установите необходимую силу тока. Обычно рекомендуется начать с небольшого значения и постепенно увеличивать его.
- Наблюдайте за происходящим электролизом. Вы можете заметить, что на катоде (отрицательном электроде) начинают появляться медные отложения, а на аноде (положительном электроде) происходит выделение газа.
- Продолжайте электролиз в течение некоторого времени, чтобы добиться необходимого количества медных отложений.
Не забывайте следить за безопасностью и соблюдать все соответствующие меры предосторожности при работе с электрическим током и химическими веществами. Если у вас возникнут проблемы или вопросы, не стесняйтесь обратиться за помощью к преподавателю или другому квалифицированному специалисту.
Так что давайте приступим к проведению электролиза и наблюдению за удивительными процессами, которые происходят в растворе нитрата меди II!
Шаг 5: Анализ полученных результатов
В процессе электролиза мы наблюдали, как вода в ёмкости с положительным электродом (анодом) окрашивается в непрозрачный голубой цвет, а на отрицательном электроде (катоде) образуется медь в виде красноватого отложения. Это указывает на то, что в результате электролиза происходит разложение нитрата меди II, в котором ионы меди переходят на катод, а ионы нитрата и воды расходуются на аноде.
Этот эксперимент подтверждает принцип сохранения массы, так как масса полученной меди на катоде равна массе ионов меди, потребленных на аноде. Также можно отметить, что проводимый электролиз протекает с высоким КПД, так как наблюдается высокая степень окрашивания воды в цвет меди.
Полученные результаты электролиза раствора нитрата меди II могут быть полезными для дальнейших исследований и применений. Например, медь, полученная в результате электролиза, может быть использована в различных отраслях промышленности, включая производство проводников, электроники и металлургии.






