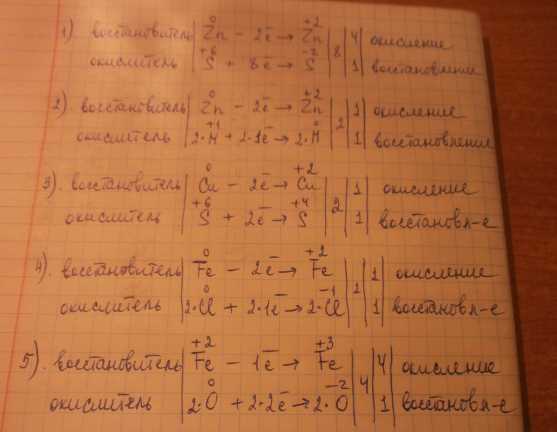
В данной инструкции я расскажу вам, как решить уравнение окислительно-восстановительной реакции между медью (Cu) и серной кислотой (H2SO4). Эта реакция приводит к образованию сернокислого меди (CuSO4), диоксида серы (SO2) и воды (H2O).
Для решения этого уравнения важно знать основные правила балансировки реакций. Первым шагом необходимо балансировать атомы, начиная с самых сложных соединений. В данном случае, мы начинаем с балансировки серной кислоты.
Следующим шагом нужно обратить внимание на атомы кислорода. В реакции у нас есть две молекулы серной кислоты и, следовательно, шесть атомов кислорода. Для балансировки количества кислорода можно добавить три молекулы воды (H2O) на правую сторону уравнения.
Далее, мы замечаем, что на левой стороне уравнения у нас есть один атом меди, а на правой стороне — один атом меди в составе молекулы сернокислого меди. Чтобы балансировать количество меди, можно добавить молекулу сернокислого меди (CuSO4) на левую сторону.
В результате выполненных действий, мы получаем окончательное уравнение Cu + H2SO4конц = CuSO4 + SO2 + H2O, которое является балансированным.
Как решить уравнение окислительно-восстановительной реакции Cu + H2SO4 -> CuSO4 + SO2 + H2O: подробная инструкция
1) Вначале, чтобы решить это уравнение, нужно определить окислитель и восстановитель в реакции. Окислитель — это вещество, принимающее электроны, а восстановитель — вещество, отдающее электроны. В данной реакции медь (Cu) окисляется, а серная кислота (H2SO4) восстанавливается.
2) Затем напишем уравнение, указав правильные коэффициенты перед каждым реагентом и продуктом реакции:
- Cu + H2SO4 -> CuSO4 + SO2 + H2O
3) Теперь решим уравнение путем балансировки. Начнем с балансировки атомов меди (Cu). В данном случае у нас 1 атом меди в реагентах и 1 атом меди в продуктах, поэтому атомы меди уже сбалансированы.
4) Затем перейдем к балансировке атомов серы (S). В реагентах мы имеем 1 атом серы в серной кислоте (H2SO4), а в продуктах у нас 1 атом серы в сульфате меди (CuSO4) и 1 атом серы в диоксиде серы (SO2). Чтобы сбалансировать атомы серы, нам нужно добавить коэффициент 2 перед H2SO4:
- Cu + 2H2SO4 -> CuSO4 + SO2 + H2O
5) Теперь мы перейдем к балансировке атомов кислорода (O). В реагентах у нас 4 атома кислорода в серной кислоте (H2SO4) и 1 атом кислорода в меди (Cu). В продуктах у нас 4 атома кислорода в сульфате меди (CuSO4) и 2 атома кислорода в воде (H2O). Чтобы сбалансировать атомы кислорода, нам нужно добавить коэффициент 4 перед H2O:
- Cu + 2H2SO4 -> CuSO4 + SO2 + 4H2O
6) Последним шагом балансировки является проверка сбалансированности зарядов и электронов в реакции. Для этого можно использовать метод полуреакций. В данном уравнении окислитель (Cu) имеет заряд +2, а восстановитель (H2SO4) имеет заряд -2. Если мы поделим уравнение на полуреакции, то получим:
- Окисление: Cu -> Cu^2+ + 2e-
- Восстановление: H2SO4 + 2e- -> H2SO4
7) Таким образом, мы убедились, что заряды и электроны в реакции сбалансированы. Получившееся окончательное сбалансированное уравнение окислительно-восстановительной реакции выглядит следующим образом:
- Cu + 2H2SO4 -> CuSO4 + SO2 + 4H2O
Вот и все! Теперь ты знаешь, как решить уравнение окислительно-восстановительной реакции Cu + H2SO4 -> CuSO4 + SO2 + H2O. Надеюсь, эта информация была полезной для тебя. Удачи в изучении химии!
Определение окислителя и восстановителя

В окислительно-восстановительных реакциях можно определить окислитель и восстановитель по изменению окислительных чисел атомов веществ. Окислительное число — это числовое значение, показывающее, сколько электронов атом получает или отдает в химической реакции.
Как правило, окислитель в реакции имеет более высокое окислительное число, чем восстановитель. Окислительный и восстановительный агенты могут быть определены с помощью следующих правил:
- Вещество, окислительное число атомов которого увеличивается в ходе реакции, является окислителем. Оно принимает электроны от других веществ и само восстанавливается.
- Вещество, окислительное число атомов которого уменьшается в ходе реакции, является восстановителем. Оно отдает электроны другим веществам и само окисляется.
Например, в реакции Cu + H2SO4 -> CuSO4 + SO2 + H2O медь (Cu) соединяется с серной кислотой (H2SO4), при этом медь окисляется из нулевого окислительного числа до +2, а серная кислота восстанавливается, потому что окислительное число атома серы увеличивается с +6 до +4. Следовательно, медь — окислитель, а серная кислота — восстановитель.
Таким образом, определение окислителя и восстановителя в окислительно-восстановительной реакции основывается на изменении окислительных чисел атомов веществ в ходе этой реакции.
Балансировка уравнения
Часто уравнения реакций не являются сбалансированными, и это может привести к неправильному пониманию процессов, происходящих в системе. Поэтому балансировка уравнения является неотъемлемой частью понимания и интерпретации химических реакций.
Для балансировки уравнений Okislenie-Vosstanovlenie (окислительно-восстановительных реакций) вам нужно следовать нескольким простым правилам. Важно помнить, что число атомов каждого элемента должно быть одинаковым на обеих сторонах уравнения, и заряд также должен быть сбалансирован.
Ваша задача — балансировать уравнение реакции Cu + H2SO4конц — CuSO4 + SO2 + H2O. Давайте начнем:
- Начните с металла — меди (Cu) на левой стороне уравнения. Уравняйте число атомов меди на обеих сторонах, добавив коэффициент 2 перед CuSO4 на правой стороне. Теперь у нас есть 2 атома Cu.
- Перейдем к серной кислоте (H2SO4конц) на левой стороне. Чтобы уравнять серу и кислород, добавьте коэффициенты 4 перед SO2 и 2 перед H2O на правой стороне. Теперь у нас есть 4 атома S и 8 атомов O на обеих сторонах.
- Последний шаг — уравнение водорода (H). Добавьте коэффициент 4 перед H2O на правой стороне, чтобы уравнять число атомов водорода. Теперь у нас есть 8 атомов H на обеих сторонах.
Итак, сбалансированное уравнение будет выглядить следующим образом:
Cu + 2H2SO4конц -> CuSO4 + 4SO2 + 2H2O
Теперь у нас сбалансированное уравнение, где число атомов каждого элемента и заряд сбалансированы на обеих сторонах. Это позволяет нам лучше понять происходящие процессы и обеспечивает правильные коэффициенты для расчета массы и количества веществ, участвующих в реакции.
Описание реакции
Изначально у нас есть медь (Cu) и концентрированная серная кислота (H2SO4). При взаимодействии меди и серной кислоты происходит окисление меди до Cu2+ и восстановление серной кислоты до SO2 и H2O.
Уравнение реакции можно записать следующим образом:
- Cu + H2SO4конц → CuSO4 + SO2 + H2O
В результате реакции образуется сернокислая медь (CuSO4), диоксид серы (SO2) и вода (H2O).
Окисление меди происходит таким образом: Cu → Cu2+ + 2e-. Это означает, что медь теряет два электрона и превращается в ион меди Cu2+.
В то же время, серная кислота восстанавливается: H2SO4 + 2e- → SO2 + 2H+ + H2O. Это означает, что серная кислота получает два электрона и превращается в диоксид серы (SO2), водородные ионы (H+) и воду (H2O).
Эта реакция происходит при наличии электролита и электродов. Медь служит как анод, на котором происходит окисление. Серная кислота служит как катод, на котором происходит восстановление.
Таким образом, реакция Cu + H2SO4конц CuSO4 + SO2 + H2O является примером окислительно-восстановительной реакции, где медь окисляется и серная кислота восстанавливается.
Проверка балансировки реакции

Мы начали с записи несбалансированного уравнения реакции и затем последовательно провели ряд шагов, чтобы достичь баланса. Балансировка основана на принципе сохранения атомарности и заряда. Мы использовали таблицу Гальтониева ряда напряжений, чтобы определить окислитель и восстановитель в реакции, а затем применили метод полу-реакций для балансировки.
В результате получено сбалансированное уравнение: Cu + 2H2SO4конц CuSO4 + SO2 + 2H2O. Проверку балансировки мы провели, проверив, что количество атомов каждого элемента одинаково в обеих частях реакции. Также мы убедились, что сумма зарядов одинакова на обеих сторонах уравнения.
Балансировка реакций является важным навыком в химии. Она позволяет нам понять, как происходят реакции и как изменяется состав веществ в процессе химической реакции. Представленная в этой статье процедура балансировки может быть использована в других окислительно-восстановительных реакциях для достижения точных результатов и более глубокого понимания химических процессов.






