- Условия разложения FeOH3
- Температура и давление в реакции разложения Fe(OH)3
- Температура:
- Давление:
- Влияние pH среды
- Роль катализаторов
- Протекание реакции разложения FeOH3
- Условия протекания реакции разложения FeOH3
- Протекание реакции разложения FeOH3
- Использование реакции разложения FeOH3
- Скорость реакции
- Механизм разложения FeOH3
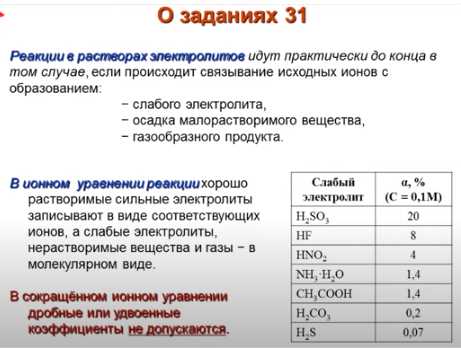
Реакция разложения FeOH3, или гидроксида железа(III), является интересным процессом, который протекает при определенных условиях. Эта реакция обычно инициируется изменением pH среды, в которой находится FeOH3. При этом происходит распад гидроксида на ионы железа и ионы гидроксида. Результатом разложения являются окислы железа(III), такие как Fe2O3 и FeO(OH), и даже металлическое железо.
Реакция разложения FeOH3 может иметь важные практические применения. Например, оксиды железа используются в производстве красок, магнитов и катализаторов. Кроме того, разложение FeOH3 может происходить в природных условиях, что способствует образованию железистых отложений и грунтов. Понимание протекания этой реакции и условий, при которых она происходит, важно для разных областей науки и промышленности.
Условия разложения FeOH3
Разложение FeOH3, или гидроксида железа(III), происходит при определенных условиях. Во-первых, для начала процесса разложения необходимо наличие некоего источника тепла. Температура должна быть достаточно высокой, чтобы активировать разложение вещества.
Кроме того, разложение FeOH3 может протекать в присутствии кислорода. Кислород играет важную роль в этом процессе, поскольку он вступает в реакцию с железом, образуя оксиды железа. Поэтому, чтобы разложение гидроксида железа(III) происходило успешно, атмосфера или среда, в которой происходит реакция, должна содержать достаточное количество кислорода.
Для протекания реакции разложения FeOH3 также может потребоваться добавление катализатора или стимулятора, который ускорит процесс разложения. Такой катализатор может быть добавлен как вещество, присутствующее в реакционной среде, так и в виде добавок к исходному веществу FeOH3.
Когда все условия для разложения FeOH3 выполнены, процесс начинается. Гидроксид железа(III) разлагается на оксиды железа и воду. Данный процесс может быть представлен следующим уравнением реакции:
FeOH3 → Fe2O3 + H2O
Таким образом, разложение гидроксида железа(III) происходит при высокой температуре, в присутствии кислорода и под влиянием катализаторов или стимуляторов. Этот процесс может быть важным для различных приложений, таких как промышленные процессы или ведение химических реакций в лаборатории. Использование знаний об условиях разложения FeOH3 может быть полезным для оптимизации данных процессов и получения желаемых продуктов.
Температура и давление в реакции разложения Fe(OH)3

Когда речь заходит о реакции разложения гидроксида железа Fe(OH)3, температура и давление играют важную роль в ее протекании и использовании. Понимание и контроль этих параметров помогают нам оптимизировать процесс и обеспечить максимальный эффект.
Температура:
Температура является одним из ключевых факторов, влияющих на скорость реакции разложения Fe(OH)3. Обычно разложение начинается при температуре около 80-100°C, но реакция будет протекать быстрее при повышении температуры. Высокая температура активирует молекулы гидроксида железа, увеличивая скорость и энергию их движения. Это приводит к ускорению разложения и высвобождению воды и кислорода.
Однако стоит отметить, что повышение температуры может сопровождаться такими эффектами, как испарение воды, образование оксидов железа и изменение структуры и свойств образующихся продуктов. Поэтому важно контролировать температуру реакции, чтобы не потерять эффективность процесса.
Давление:
В отличие от температуры, давление не оказывает прямого влияния на протекание реакции разложения Fe(OH)3. Однако изменение давления может влиять на равновесие между гидроксидом железа и полученными продуктами. Высокое давление может сдвигать равновесие в сторону реакции разложения, ускоряя процесс.
В свою очередь, низкое давление может замедлять реакцию, так как равновесие будет стремиться к сохранению исходного вещества. Поэтому при оптимизации процесса разложения Fe(OH)3 необходимо учитывать и давление, хотя его влияние не является столь значительным, как температуры.
Рассматривая роль температуры и давления в реакции разложения Fe(OH)3, мы понимаем, что правильное их контролирование и оптимизация могут помочь улучшить эффективность процесса и получить максимальное количество требуемых продуктов.
Влияние pH среды
Влияние pH среды на процесс разложения FeOH3 имеет ключевое значение, поскольку pH определяет активность и стабильность различных ионов в растворе.
Когда раствор FeOH3 находится в кислой среде с низким pH, происходит одновременное образование ионов Fe3+ и OH-, при этом FeOH3 остается в основном в виде нестабильных гидроксокомплексов. Это приводит к повышенной вероятности разложения FeOH3.
В то же время, в щелочной среде с высоким pH, ионы OH- преобладают, и FeOH3 превращается в стабильные комплексы с ионами OH-. Это значительно снижает скорость разложения FeOH3 и предотвращает его полное разложение.
Таким образом, pH среды является фактором, который прямо влияет на процесс разложения FeOH3. Поддержание оптимального pH, близкого к нейтральному, обеспечивает стабильность раствора и предотвращает разложение FeOH3.
Изучение влияния pH среды на процесс разложения FeOH3 имеет практическое значение в различных областях, включая промышленность, медицину и науку. Знание оптимальных условий pH помогает контролировать и оптимизировать процессы, в которых используется FeOH3, а также обеспечивает безопасность и эффективность его использования.
Роль катализаторов
Катализаторы играют важную роль в химических реакциях, ускоряя их протекание. Они снижают энергию активации, необходимую для запуска реакции, и увеличивают скорость реакции без того, чтобы сами участвовать в реакции.
Катализаторы могут быть различных типов, включая металлы, оксиды металлов и ферменты. Они обладают специальными свойствами, которые позволяют им принимать активное участие в реакциях и взаимодействовать с реакционными компонентами.
В случае разложения FeOH3 катализаторы могут изменить активность гидроксида железа, что сделает реакцию более эффективной и быстрой. Они могут обеспечить рассеивание тепла в реакции, обеспечить оптимальное распределение реагентов и улучшить взаимодействие между ними.
Катализаторы, такие как кислоты или основания, могут также изменять pH среды, что также влияет на протекание реакции разложения FeOH3. Они могут создать более благоприятные условия для реакции, оптимизировать концентрацию реагентов и продуктов, а также стабилизировать промежуточные соединения.
Использование катализаторов может быть важным фактором в промышленных процессах, таких как производство удобрений или неорганических соединений. Они могут повысить эффективность и производительность процесса, сократить затраты на энергию и сырье, а также уменьшить вредные выбросы.
Примеры катализаторов:
- Металлические катализаторы, такие как платина, никель или палладий;
- Оксиды металлов, например, оксид цинка или оксид меди;
- Ферменты, такие как липазы или амилазы.
Каталитические процессы являются важными в нашей повседневной жизни и применяются в различных сферах, включая промышленность, медицину и производство энергии. Их использование помогает нам эффективно использовать ресурсы и минимизировать отрицательное влияние на окружающую среду.
Протекание реакции разложения FeOH3
Условия протекания реакции разложения FeOH3
Реакция разложения FeOH3 происходит при нагревании этого соединения. Чтобы реакция успешно протекала, необходимо обеспечить следующие условия:
- Наличие начальных реагентов — гидроксида железа(III), FeOH3.
- Энергия в виде тепла, которая может быть предоставлена, например, при помощи нагревания.
- Подходящая температура, которая должна быть достаточно высокой для инициирования реакции разложения, но не слишком высокой, чтобы не породить побочные эффекты.
Интересно, что реакция разложения FeOH3 может быть противоречивой, где в некоторых случаях она может проходить обратно при наличии определенных условий. Это может быть связано с влиянием других факторов, таких как давление и концентрация реагентов, что может привести к обратной реакции.
Протекание реакции разложения FeOH3
Реакция разложения FeOH3 происходит следующим образом:
- Начальное вещество — FeOH3, подвергается нагреванию и разлагается на оксид железа(III) и воду.
- Уравнение реакции выглядит следующим образом: FeOH3 → Fe2O3 + H2O.
- Полученный оксид железа(III) может использоваться в дальнейших процессах или применяться в различных отраслях промышленности.
Использование реакции разложения FeOH3
Реакция разложения FeOH3 имеет широкий спектр применения в различных областях, включая:
- Производство различных видов оксидов железа, которые используются в производстве красителей, керамики и других материалов.
- Использование как катализатора в химических реакциях.
- Применение в производстве ферритов, магнитных материалов с высокой магнитной проницаемостью.
Данный процесс обладает большим потенциалом в различных областях приложения и открывает новые возможности для развития науки и технологии. Протекание реакции разложения FeOH3 является важным шагом в процессах химического исследования и промышленного производства.
Скорость реакции
Во-первых, одним из главных факторов, влияющих на скорость реакции, является концентрация реагентов. Чем выше концентрация реагентов, тем больше частиц реагирующих веществ необходимо для образования продуктов, и, следовательно, реакция протекает быстрее. Кроме того, повышение концентрации может увеличить вероятность столкновения между реагентами.
Во-вторых, температура также оказывает существенное влияние на скорость реакции. Повышение температуры увеличивает энергию молекул реагентов, что способствует более активным столкновениям между ними. Это с учетом того, что тепловое движение ускоряется с повышением температуры.
Третьим фактором, оказывающим влияние на скорость реакции, является наличие катализатора. Катализаторы — это вещества, которые повышают скорость реакции, не участвуя в ней непосредственно. Они способны снижать энергию активации реакции, что делает ее более легкой и быстрой.
Кроме перечисленных факторов, на скорость реакции также влияют другие факторы, такие как поверхность реакции, давление, pH-значение и наличие ингибиторов.
Что же делать, если нам нужно изменить скорость реакции? Здесь мы можем использовать знания о факторах, оказывающих влияние на скорость, и применять соответствующие стратегии. Например, мы можем изменять концентрацию реагентов путем добавления большего количества вещества или разведения раствора. Также можно изменять температуру реакции, нагревая или охлаждая ее, чтобы увеличить или уменьшить скорость.
Использование катализаторов тоже может быть эффективным методом ускорения реакции. Для этого необходимо добавить катализатор в реакционную смесь и обеспечить оптимальные условия для его работы.
В общем, скорость реакции — это важный параметр, который позволяет нам контролировать химические процессы. Знание о факторах, влияющих на скорость реакции, помогает нам лучше понимать и управлять этими процессами. Не забывайте об этом в своих химических экспериментах и расследованиях!
Механизм разложения FeOH3
При нагревании гидроксид железа(III) дегидратируется, образуя оксид железа(III) и воду. Уравнение реакции выглядит следующим образом:
- FeOH3 → Fe2O3 + H2O
Эта реакция может протекать при температуре около 380-400°C. Гидроксид железа(III) здесь действует в качестве источника кислорода для окисления железа.
В присутствии кислоты, FeOH3 растворяется с образованием соли железа(III) и воды. Например, соляная кислота может использоваться для разложения гидроксида железа(III) по следующему уравнению:
- FeOH3 + 3HCl → FeCl3 + 3H2O
Эта реакция возможна при комнатной температуре и не требует нагревания. Отметим, что кислота действует здесь в качестве протонационного агента, способствующего диссоциации гидроксида железа(III).
Таким образом, разложение FeOH3 может протекать как при нагревании, так и в присутствии кислоты. Эти два механизма позволяют получать оксид железа(III) и соли железа(III) соответственно. Данные реакции имеют практическое значение и применяются в различных отраслях науки и промышленности.






