
Когда реакция между азотной кислотой (HNO3) и гидроксидом меди (Cu(OH)2) происходит, образуется нитрат меди (Cu(NO3)2) и вода (H2O). Данная реакция представляет собой типичную реакцию двойного обмена, где ионы кислоты и ионы гидроксида обмениваются ионами металла и ионами гидроксила.
Образующийся нитрат меди – растворимая соль с ярко-голубой окраской. Он может использоваться в различных областях, включая промышленность и науку.
Реакция HNO3 + Cu(OH)2 рассматривается и изучается в химических лабораториях и учебных заведениях, где ее механизм и свойства изучаются с целю понимания основ химических реакций и их применения в различных областях.
Описание реакции HNO3 + Cu(OH)2
Реакция между азотной кислотой (HNO3) и гидроксидом меди (Cu(OH)2) приводит к образованию ионов меди и азотата. В результате этой химической реакции оба реагента меняют свою структуру и образуют новые вещества.
Когда азотная кислота, HNO3, вступает в реакцию с гидроксидом меди, Cu(OH)2, происходит обмен ионов. Азотатные ионы (NO3-) образуются из азотной кислоты, а медные ионы (Cu2+) образуются из гидроксида меди. Таким образом, ионы меди и ионы азотата образуют новые соединения, которые растворяются в воде и могут быть идентифицированы при помощи различных химических тестов.
Тепловая реакция между азотной кислотой и гидроксидом меди является экзотермической, то есть выделяется тепло. Реакция происходит довольно быстро при комнатной температуре и не требует каких-либо специальных условий для активации.
Результаты реакции можно наблюдать визуально. Гидроксид меди, который изначально имеет голубой цвет, реагирует с азотной кислотой, и его цвет изменяется на зеленый или синий. Это изменение цвета является одним из показателей того, что реакция происходит. Также можно обнаружить образование пены или газовых пузырьков в результате выделения диоксида азота.
Важно отметить, что эту реакцию можно рассматривать как нейтрализацию, так как азотная кислота, являющаяся кислотой, реагирует с гидроксидом меди, являющимся щелочью, и образует соль и воду. В данном случае соль представлена азотатными ионами меди (Cu(NO3)2) и водой (H2O).
Таким образом, реакция HNO3 + Cu(OH)2 является важной химической реакцией, которая приводит к образованию новых веществ и позволяет исследовать взаимодействие различных химических реагентов. Понимание этой реакции помогает в изучении основных принципов химии и может быть использовано в различных технических и научных приложениях.
Общие сведения о реакции HNO3 + CuOH2
Реакция между HNO3 (нитратной кислотой) и Cu(OH)2 (гидроксидом меди(II)) может быть очень интересной! Давайте обсудим ее подробнее.
Когда HNO3 реагирует с Cu(OH)2, происходит обмен ионами: ионы H+ замещают ионы Cu2+. Это приводит к образованию двух новых соединений: Cu(NO3)2 (нитрат меди(II)) и H2O (воды).
- Нитрат меди(II) (Cu(NO3)2) представляет собой соль, которая может быть использована для различных целей, включая катализаторы и окраску стекла.
- Вода (H2O) является основным продуктом реакции и не оказывает существенного влияния на окружающую среду.
Важно отметить, что реакция HNO3 + Cu(OH)2 происходит быстро и может сопровождаться выделением тепла и пены. Это вызвано образованием газов, которые выходят из раствора в виде пузырьков.
Помните, что для проведения данной реакции необходимо быть осторожными, так как нитратная кислота HNO3 является коррозионно-опасным веществом и может вызывать ожоги или другие повреждения, если попадет на кожу или в глаза. Поэтому, при работе с нитратной кислотой, необходимо соблюдать все меры предосторожности и использовать защитную экипировку.
| Реактивы | Продукты |
|---|---|
| HNO3 (нитратная кислота) | Cu(NO3)2 (нитрат меди(II)) |
| Cu(OH)2 (гидроксид меди(II)) | H2O (вода) |
Так что теперь вы знаете больше о реакции HNO3 + Cu(OH)2! Учтите, что реакция характеризуется обменом ионами, образованием новых соединений и может сопровождаться выделением тепла и пены.
Формула реакции между HNO3 и CuOH2 можно записать следующим образом:
2HNO3 + CuOH2 → Cu(NO3)2 + 2H2O
В данной реакции две молекулы азотной кислоты (HNO3) реагируют с одной молекулой гидроксида меди (CuOH2), что приводит к образованию одной молекулы нитрата меди (Cu(NO3)2) и двух молекул воды (H2O).
Эта реакция является типичной реакцией кислоты с основанием. В данном случае, азотная кислота (HNO3) диссоциирует на ионы водорода (H+) и ионы нитрата (NO3-). Гидроксид меди (CuOH2) также диссоциирует на ионы меди (Cu2+) и ионы гидроксида (OH-).
В процессе реакции, ионы водорода (H+) из азотной кислоты реагируют с ионами гидроксида (OH-) из гидроксида меди, образуя молекулы воды (H2O). Остающиеся ионы нитрата (NO3-) и меди (Cu2+) образуют нитрат меди (Cu(NO3)2).
Таким образом, реакция между HNO3 и CuOH2 протекает с образованием нитрата меди и воды.
Важно отметить, что данная формула является упрощенной и не учитывает возможные состояния агрегации веществ, такие как твердые или жидкие фазы. Также следует учитывать, что в химических реакциях могут происходить различные боковые реакции или изменения окислительно-восстановительного состава веществ. Тем не менее, данная формула является хорошим представлением основной реакции между HNO3 и CuOH2.
Механизм реакции
Давайте проведем глубокий анализ реакции между кислотой азотной (HNO3) и гидрооксидом меди (Cu(OH)2). Эта реакция представляет собой превращение одного вещества в другое, и мы можем разобраться, каким образом происходит это превращение.
В начале реакции HNO3 и Cu(OH)2 взаимодействуют, образуя основные компоненты новых веществ. Когда эти вещества взаимодействуют, их атомы и молекулы перестраиваются, образуя новые связи.
Механизм реакции может быть представлен следующим образом:
- Сначала ионы HNO3 диссоциируют в растворе, образуя ионы H+ и NO3—. Эти ионы затем взаимодействуют с ионами Cu2+ и OH—.
- Частичная гидролиза ионов Cu2+ и OH— приводит к образованию неподвижных ионов Cu(OH)2. Эта реакция может быть представлена следующим образом:
- Cu2+ + 2OH— ⇌ Cu(OH)2
- Далее ионы H+ и NO3— реагируют с Cu(OH)2, образуя HNO3 и Cu2+:
- H+ + NO3— + Cu(OH)2 ⇌ Cu2+ + HNO3 + H2O
Важность реакции HNO3 + Cu(OH)2
Одним из ключевых аспектов важности этой реакции является ее использование в аналитической химии. Реакция HNO3 + Cu(OH)2 применяется для анализа и обнаружения присутствия и концентрации меди в различных образцах. Этот метод широко используется в химическом исследовании, чтобы определить содержание меди в различных материалах, например в почве, воде или изделиях из меди. Точная оценка содержания меди позволяет контролировать ее использование и применение в различных областях промышленности.
Кроме того, реакция HNO3 + Cu(OH)2 используется в производстве различных материалов и соединений. Полученный из этой реакции осадок меди(II) гидроксида может быть дальше использован для получения других важных материалов, таких как медные соли. Медные соли широко применяются в производстве красителей, пигментов, катализаторов, и других химических соединений. Поэтому, понимание и оптимизация реакции HNO3 + Cu(OH)2 играют важную роль в разработке и производстве различных химических веществ, которые находят широкое применение в различных отраслях промышленности.
Кроме применения в науке и промышленности, реакция HNO3 + Cu(OH)2 имеет медицинские применения. Меди(II) гидроксид, полученный в процессе этой реакции, может использоваться в медицинских изделиях и препаратах, таких как протезы, лекарственные средства и антибактериальные материалы. Это связано с антимикробными свойствами меди, которые используются для борьбы с бактериальными инфекциями и создания стерильных условий.
Применение реакции HNO3 + Cu(OH)2
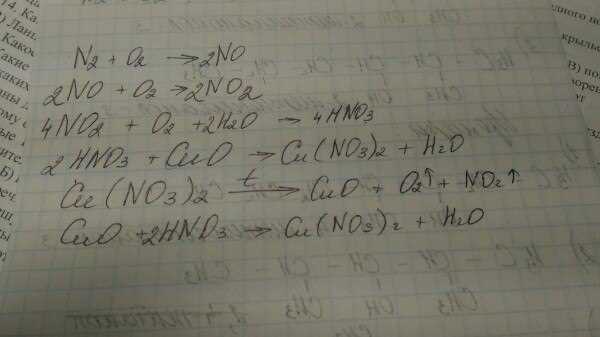
Реакция HNO3 + Cu(OH)2 представляет собой химическую реакцию между азотной кислотой и гидроксидом меди. Эта реакция широко применяется в различных промышленных и научных областях. Заключение по данной теме представлено ниже:
Использование в аналитической химии
Реакция HNO3 + Cu(OH)2 находит применение в аналитической химии в качестве метода определения концентрации азотной кислоты в образцах. При реакции между нитратной кислотой и гидроксидом меди образуется нитрат меди и вода. Изменение цвета раствора после реакции может быть использовано для определения содержания азотной кислоты в образце.
Применение в производстве удобрений
Реакция HNO3 + Cu(OH)2 также может быть использована в производстве удобрений. Нитратная кислота является основным источником азота в удобрениях, а медь может использоваться в качестве катализатора процесса синтеза удобрений. Реакция HNO3 + Cu(OH)2 может быть использована для получения нитрата меди, который может быть использован в производстве нитратных удобрений.
Использование в гальванической покраске
Гальваническое покрытие медью широко используется для защиты металлических поверхностей от коррозии. Реакция HNO3 + Cu(OH)2 может быть использована для получения раствора нитрата меди, который может быть использован в гальванической покраске. Раствор нитрата меди может быть использован в качестве электролита для нанесения тонкого слоя меди на поверхность предметов.
Реакция HNO3 + Cu(OH)2 имеет широкий спектр применения в различных областях. Она может быть использована в аналитической химии для определения концентрации азотной кислоты, в производстве удобрений для получения нитрата меди, а также в гальванической покраске для защиты металлических поверхностей. Понимание и правильное использование данной реакции играет важную роль в различных промышленных и научных областях.






