
Реакция AlCl3 с избытком KOH — это химическая реакция, которая происходит между соединениями алюминия и калия. Главные этапы данной реакции включают образование осадка, растворение осадка и образование новых реакционных продуктов.
На первом этапе происходит образование осадка — гидроксида алюминия (Al(OH)3), который обычно имеет белый цвет. Затем, при дальнейшем взаимодействии, осадок растворяется, образуя комплексные ионы алюминия и гидроксида.
В результате реакции образуются основные реакционные продукты — алюминат калия (KAl(OH)4) и хлорид калия (KCl). Гидроксид алюминия (Al(OH)3), который изначально образовался в виде осадка, растворяется и превращается в комплексные ионы.
Реакция AlCl3 с избытком KOH является важным процессом в химии и может иметь различные практические применения.
Описание реакции AlCl3 с избытком KOH:
В реакции между AlCl3 (алюминий хлорид) и избытком KOH (калия гидроксида) происходят несколько этапов, в результате которых образуются реакционные продукты.
На первом этапе алюминий хлорид (AlCl3) реагирует с калием гидроксидом (KOH). При этом происходит образование алюминия гидроксида (Al(OH)3) и KCl (хлорид калия). Это можно представить следующим уравнением реакции:
AlCl3 + 3KOH → Al(OH)3 + 3KCl
В результате этой реакции образуется осадок белого цвета – гидрооксид алюминия (Al(OH)3). Гидрооксид алюминия является амфотерным оксидом, то есть он может проявлять и кислотные, и основные свойства.
Далее, на втором этапе происходит нейтрализация гидрооксида алюминия за счет избытка калия гидроксида. В результате этой реакции образуется калий алюминат (KAl(OH)4):
Al(OH)3 + 3KOH → KAl(OH)4
Калий алюминат является солью силной кислоты (гидроксид алюминия) и сильного основания (калия гидроксид) и имеет амфотерные свойства. Он растворимый в воде и имеет алкалиновый характер.
Итак, реакция AlCl3 с избытком KOH приводит к образованию осадка гидрооксида алюминия (Al(OH)3) и растворимой соли калия алюмината (KAl(OH)4).
Подготовка реакционных компонентов
Для проведения реакции между AlCl3 и KOH, необходимо подготовить оба реакционных компонента. Рассмотрим процесс подготовки каждого из них.
Подготовка AlCl3
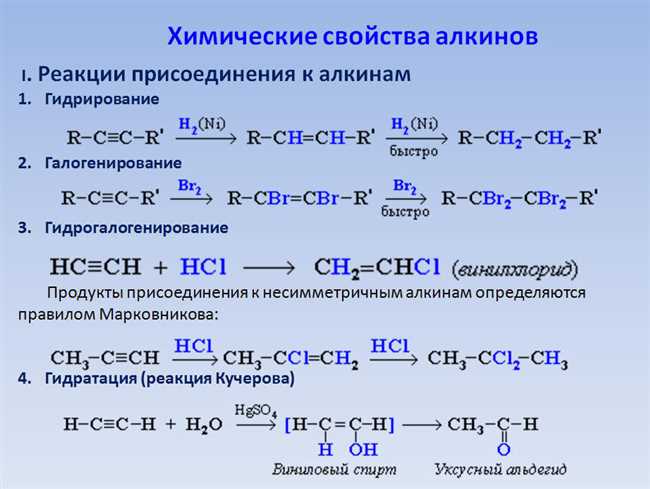
AlCl3, или алюминий хлорид, является бинарным химическим соединением, состоящим из алюминия (Al) и хлора (Cl). Его можно получить путем реакции алюминия с хлоридом водорода (HCl) или хлоридом натрия (NaCl). В данном случае мы не будем останавливаться на методе получения AlCl3, а сосредоточимся на его использовании в реакции с KOH.
Подготовка KOH
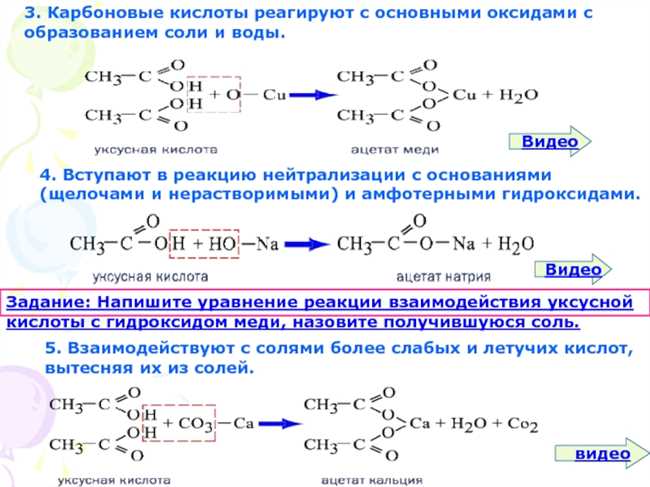
KOH, или калиевая гидроксид, представляет собой щелочь, состоящую из калия (K) и гидроксильного иона (OH-). Она широко используется в различных химических процессах и может быть получена путем электролиза раствора калия с использованием платинового электрода.
Для подготовки раствора KOH, необходимо взвесить определенное количество калия (K) и добавить его в раствор воды (H2O). Взаимодействие калия с водой приводит к выделению гидроксильных ионов, что делает раствор KOH щелочным. В результате получаем раствор KOH, готовый к использованию в реакции с AlCl3.
В целом, подготовка реакционных компонентов для реакции AlCl3 с избытком KOH является стандартной процедурой в химической лаборатории. Однако, важно учесть, что при работе с этими химическими веществами необходимо соблюдать соответствующие меры безопасности, так как они могут быть опасными при неправильном использовании.
Образование гидроксида алюминия
Главные этапы реакции AlCl3 с избытком KOH:
- Вначале происходит образование гидроксоксозолята алюминия, Al(OH)4-, который является основным промежуточным продуктом реакции.
- Затем промежуточный продукт гидролизуется до образования гидроксида алюминия Al(OH)3 и калия, KOH.
Гидроксид алюминия — это белый аморфный порошок, не растворимый в воде. В чистом виде он обычно встречается в форме гидратированных кристаллов, таких как Al(OH)3 · nH2O, где n — число молекул воды. Избыток KOH используется в реакции для обеспечения полного превращения AlCl3 в гидроксид алюминия.
Гидроксид алюминия имеет множество применений. Он используется в производстве лекарственных препаратов, антиперспирантов, косметических средств, жидкостей для замерзания стекол и других продуктов. Также он может использоваться в качестве катализатора в химических реакциях.
Взаимодействие гидроксида алюминия с хлоридом калия
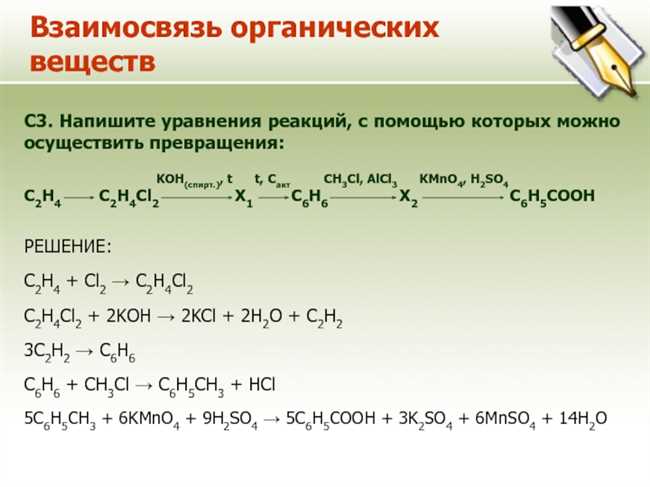
Основной этап этой реакции состоит в том, что ионы алюминия (Al3+) и ионы калия (K+) образуют нерастворимый осадок алюминия гидроксида (Al(OH)3) в общем растворе. Формула образующегося осадка гидроксида алюминия соответствует соотношению между ионами алюминия и ионами гидроксида.
Уравнение реакции между гидроксидом алюминия и хлоридом калия можно записать следующим образом:
Al(OH)3 + 3KCl → AlCl3 + 3KOH
Таким образом, в результате реакции гидроксид алюминия превращается в алюминий хлорид, а хлорид калия в гидроксид калия. Хлорид алюминия (AlCl3) и гидроксид калия (KOH) являются реакционными продуктами.
Эта реакция обладает практическим применением в различных процессах, таких как производство алюминия и его соединений, а также в качестве катализатора различных химических реакций.
Выделение осадка
Если мы рассматриваем реакцию между AlCl3 и избытком KOH, то первым этапом этой реакции будет образование алюминия гидроксида (Al(OH)3). Это происходит из-за того, что ионы гидроксида KOH реагируют с ионами алюминия AlCl3 и образуют алюминий гидроксид.
Al3+ + 3OH- → Al(OH)3
В данной реакции участвует избыток KOH, поэтому все ионы алюминия будут прореагированы с гидроксидами, образуя осадок гидроксида алюминия. Гидроксид алюминия — это белый осадок, который обычно выпадает при данной реакции.
Таким образом, осадок, который выделяется во время данной реакции, будет представлять собой гидроксид алюминия (Al(OH)3). Этот осадок может быть обнаружен в виде мелких белых частиц, которые оседают на дне реакционной смеси или формируют твердые грудки.
Итак, по мере протекания реакции и осаждения гидроксида алюминия, вы сможете наблюдать образование осадка. Это может служить визуальной подтверждение того, что реакция действительно проходит.
Интересно ли было узнать об этом процессе выделения осадка? Какие еще вопросы у вас возникли?
Формирование реакционных продуктов
Реакция между алюминий хлоридом (AlCl3) и избытком гидроксида калия (KOH) ведет к образованию основного комплексного алюминатного соединения и выделению кислорода. Процесс происходит в несколько этапов:
- В начале реакции алюминий хлорид растворяется в воде, образуя алюминиевые и хлоридные ионы.
- Избыток гидроксида калия вводится в раствор, благодаря чему происходит образование осадка гидроксида алюминия (Al(OH)3).
- При добавлении дополнительного количества гидроксида калия, осадок гидроксида алюминия растворяется, образуя алюминатные ионы.
- В результате образуются два основных продукта реакции: гидроксид алюминия (Al(OH)3) и алюминат калия (KAl(OH)4).
Таким образом, реакция AlCl3 с избытком KOH приводит к образованию гидроксида алюминия и алюмината калия. Эти соединения обладают определенными химическими и физическими свойствами, которые могут найти применение в различных областях науки и техники.






