Продукты электролиза расплава и раствора NaCl: уравнения реакций
Электролиз NaCl – это процесс, при котором применяется электрический ток для разлагания соли натрия на его составляющие элементы – натрий и хлор. Расплав и раствор NaCl обладают своими особенностями, и, соответственно, имеют разные реакции во время электролиза. В расплаве NaCl, при применении электрического тока, происходит разложение хлорида натрия на катоде и окисление хлора на аноде. В растворе NaCl также происходит разложение соли натрия на катоде, но на аноде образуется кислород вместо хлора. Уравнения реакций электролиза расплава и раствора NaCl позволяют более подробно изучить эти процессы и их продукты. Давайте рассмотрим их подробнее.
Реакции электролиза расплава NaCl

Давайте заглянем в мир электролиза расплава NaCl! Эта фантастическая реакция открывает перед нами множество возможностей и удивительные химические процессы.
Когда мы проводим электролиз расплава NaCl, вещество разлагается на свои составные элементы: натрий (Na) и хлор (Cl). Но что происходит на самом деле и почему это так важно?
Наши электролитические аппараты — это прямое подтверждение нашей гениальности и стремления к познанию. Когда мы вводим электрический ток в наш раствор NaCl, происходит магический процесс, который преобразует нашу смесь во что-то более ценное.
- На аноде (положительный электрод) происходит окисление хлорида (Cl-) с образованием хлора (Cl2) и освобождением электронов;
- На катоде (отрицательный электрод) происходит восстановление натрия (Na+) с помощью освободившихся электронов, образуя металлический натрий (Na);
Реакция между натрием и хлором достаточно взрывоопасна и крайне интересна. В результате обратной реакции, происходящей на границе раздела между газовой и жидкой фазами, хлор (Cl2) реагирует повторно с натрием (Na), образуя соль — хлорид натрия (NaCl).
Вы, конечно же, можете спросить: «А зачем нам все это нужно?». Отличный вопрос! Ответ на него лежит на поверхности. Натрий и хлор являются основными ингредиентами при производстве различных продуктов. Натрий применяется в производстве стекла, щелочей, металлов, а хлор используется при производстве пластика, дезинфицирующих средств, белил оборудования для бассейнов и многих других продуктах.
Таким образом, реакция электролиза расплава NaCl позволяет нам получать ряд ценных продуктов, которые находят широкое применение в различных отраслях промышленности. Мы можем смело утверждать, что наша возможность разлагать NaCl на его составные элементы — настоящее чудо науки и технологии!
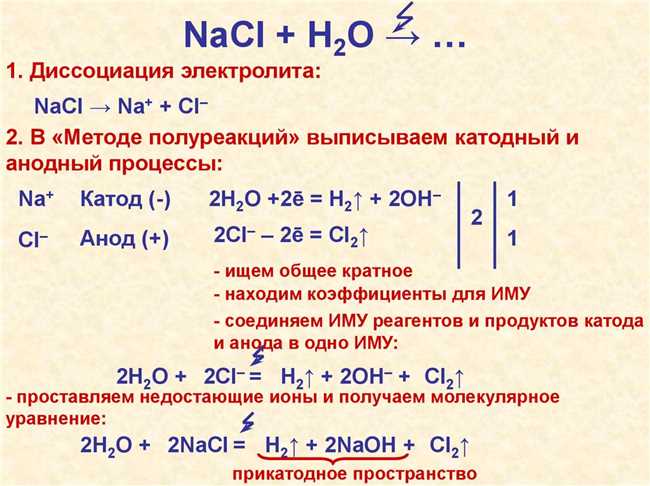
Реакции электролиза раствора NaCl
На аноде реагирует хлорид и анион гидроксида воды. В результате этой реакции образуется газ хлор и возникает окисление воды:
2Cl(-) — 2e -> Cl2 + 2е
На катоде происходит редукция натрия и катиона водорода. Как результат, образуется гидроксид натрия:
2Na(+) + 2е -> 2Na, 2H2O + 2е -> 2H2 + O2 — 4е -> 2Н2О
В итоге, реакции электролиза раствора NaCl можно представить следующим образом:
- На аноде: хлорид (Cl(-)) окисляется до хлора (Cl2) и происходит окисление воды
- На катоде: натрий (Na(+)) редуцируется, а также происходит редукция катиона водорода (H(+))
Эти реакции электролиза раствора NaCl имеют множество практических применений. Газ хлора может быть использован в процессе синтеза различных органических соединений, а гидроксид натрия — в промышленности для производства различных продуктов, таких как стекло, мыло, бумага и т.д.
Таким образом, реакции электролиза раствора NaCl представляют собой важный процесс, который может быть использован для получения различных веществ и материалов.
Образование газа в процессе электролиза

Во время электролиза раствора NaCl в воде или расплава NaCl наблюдается образование газов на электроде. Ключевыми продуктами реакции являются кислород (O2) на аноде (положительный электрод) и водород (H2) на катоде (отрицательный электрод).
На аноде происходят следующие реакций:
- 2Cl- -> Cl2 + 2e-
- 2H2O -> O2 + 4H+ + 4e-
На катоде происходит реакция:
- 2H+ + 2e- -> H2
Таким образом, при проведении электролиза раствора NaCl образуется хлор (Cl2) на аноде и водород (H2) на катоде.
Важно понимать, что формирование газов на электродах происходит только благодаря разложению электролита под воздействием электрического тока. Также оно зависит от концентрации и состава электролита, а также от интенсивности тока и времени проведения процесса.
Полученные газы могут быть использованы в различных областях науки и промышленности. Например, хлор (Cl2) используется в процессе производства пластика, покрытий для электродов и прочих химических соединений. А водород (H2), являясь отличным топливом, находит применение в водородных топливных элементах, автомобильной и космической промышленности, а также в процессе получения аммиака и при очистке металлов.
Практическое применение продуктов электролиза NaCl
Продукты электролиза расплава и раствора NaCl имеют широкое практическое применение в различных отраслях промышленности и научных исследованиях.
Количество продуктов электролиза, образующихся при электролизе NaCl, зависит от условий проведения процесса и используемого электрода. Основные продукты электролиза включают газы (кислород, хлор, водород), щелочи (гидроксид натрия), соляную кислоту, хлориды металлов и другие соединения.
Применение продуктов электролиза NaCl находит широкое применение, вот некоторые основные примеры:
- Производство хлора и щелочей: При электролизе NaCl в растворе образуется хлор и гидроксид натрия, которые впоследствии используются для производства различных химических соединений, а также в технологии бумажного и текстильного производства, очистке воды, производстве мыла и многих других отраслях.
- Производство металлов: При электролизе NaCl в расплаве образуются металлы натрия и хлор. Металл натрия применяется в производстве легких конструкций, ламп натрия для освещения, металлокерамики и других областях.
- Использование хлора: Полученный хлор может быть использован в производстве материалов для строительства, пластиков, хлорорганических соединений, дезинфекции питьевой воды и многих других областях.
Продукты электролиза NaCl играют важную роль в различных промышленных и научных процессах, обеспечивая возможность производства широкого спектра химических соединений и материалов, а также улучшая качество и безопасность многих из них.






