
Молярная масса азота N2 — это важная характеристика азота, относящаяся к его атомной массе и выражающаяся в граммах на моль. Этот параметр играет важную роль в химических расчетах, таких как определение количества вещества через массу или наоборот. Обычно азот представлен в виде молекул N2, которая состоит из двух атомов азота. Молярная масса N2 рассчитывается путем суммирования масс двух атомов азота, которые равны примерно 14 г/моль каждый. Таким образом, молярная масса азота N2 составляет около 28 г/моль. Этот параметр является необходимым для понимания химической природы азота и его влияния на физические и химические процессы.
Расчет молярной массы азота N2
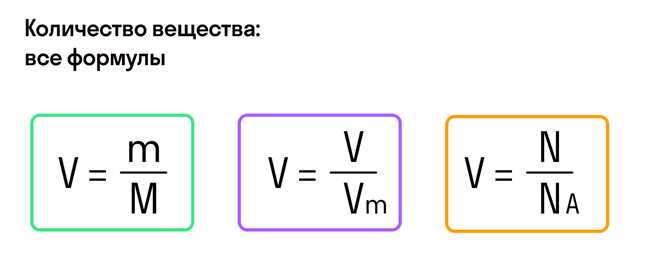
Атомный массовый номер азота равен 14. А так как в молекуле N2 содержится 2 атома азота, мы можем умножить атомный массовый номер на 2, чтобы получить массу одной молекулы N2.
14 x 2 = 28
Таким образом, молярная масса азота (N2) составляет 28 г/моль.
Атомная масса азота

Перед тем, как мы войдем в детали атомной массы азота, давайте проведем небольшой эксперимент. Представьте, что у вас есть мешок с медными монетами. Теперь возьмите одну медную монету и положите ее на весы. Вес монеты, который мы измеряем, представляет собой массу этой монеты, выраженную в граммах или других единицах массы. Итак, масса одной медной монеты равна, предположим, 2 граммам. Теперь представьте, что вы хотите знать массу всех медных монет в вашем мешке. Вы можете поместить все монеты на весы и измерить их общую массу. Затем поделите это число на количество монет в мешке, чтобы получить среднюю массу одной монеты. В этом примере, если общая масса монет в мешке равна 200 граммам, а количество монет равно 100, то средняя масса одной монеты будет составлять 2 грамма, та же самая масса, которую мы измерили ранее.
Теперь, когда мы понимаем концепцию средней массы, давайте вернемся к атомной массе азота. Атомная масса азота, равная 14,00674 атомных единиц, означает среднюю массу одного атома азота. Что же касается системы атомных единиц, то она основана на массе атома углерода-12, присвоенной ровно 12 атомных единиц. Это значит, что атом азота имеет массу в 14,00674 раза больше массы атома углерода-12.
Атомная масса азота играет важную роль в науке и инженерии. Она позволяет исследователям и инженерам точно рассчитывать количество и массу атомов в химических соединениях и материалах. Это важно для понимания химических реакций, расчета давления и температуры газов, а также для проектирования новых материалов и промышленных процессов.
Так что атомная масса азота — это не просто число, оно представляет собой фундаментальную характеристику атома азота, которая помогает нам понять и взаимодействовать с ним. Используя эту информацию, мы можем углубиться в мир атомов и молекул, чтобы лучше понять и контролировать химические процессы, которые происходят вокруг нас.
Расчет молярной массы азота N2
Чтобы вычислить молярную массу азота N2, нам необходимо знать атомные массы атомов азота (N). В таблице Менделеева можно найти, что атомная масса азота составляет примерно 14.01.
Поскольку азот N2 представляет собой молекулу, состоящую из двух атомов азота, мы должны умножить атомную массу азота на два для получения молярной массы N2.
Молярная масса азота N2 = 14.01 г/моль * 2 = 28.02 г/моль.
Легко запомнить эту формулу, используя простой способ: масса одного атома азота, умноженная на количество атомов в молекуле N2. И так, получаем молярную массу азота N2 равной 28.02 г/моль.
Молярная масса N2 имеет важное значение в химических расчетах. Она позволяет определить количество азота в реакции или веществе и использовать его для определения других химических свойств и составов соединений. Например, при расчете реакционной стехиометрии, массы примесей и других параметров необходимо знать молярную массу азота N2.
Таким образом, правильный расчет молярной массы азота N2 является ключевым элементом химических исследований и анализов. Эта информация помогает химикам и ученым разрабатывать новые соединения, изучать их свойства и применять их в различных технологиях и промышленных процессах.
Значение молярной массы азота N2
Теперь давайте заглянем в таблицу Менделеева, чтобы узнать значение молярной массы азота N2. Ох, да! Там она — 28.02 г/моль! Замечательно! Теперь мы знаем, что одно моль азота N2 весит примерно 28.02 г.
Теперь давайте зададим себе вопрос: зачем нам знать значение молярной массы азота N2? Ответ прост: это позволяет нам более точно проводить химические расчеты и определение количества вещества в различных реакциях. Например, если мы знаем массу источника азота, мы можем рассчитать, сколько молей этого азота содержится в этом источнике.
Понимание значения молярной массы азота N2 не только помогает нам в лаборатории, но и находит свое применение во многих других областях науки и техники. Например, инженеры используют молярную массу для расчета сведения об источниках энергии, а в медицине знание молярной массы азота N2 может быть полезным для оценки состава и дозировки препаратов.
Так что вы можете видеть, что значение молярной массы азота N2 имеет большое значение для нашего понимания мира химии и его применения. И у нас есть таблица Менделеева и математические расчеты в нашем арсенале, чтобы найти эту ценную информацию. Прекрасно!
Физические свойства азота N2
Физические свойства азота N2 включают в себя его агрегатное состояние, плотность, температуру плавления и кипения, теплоемкость и теплопроводность. Азот является газообразным при нормальных условиях температуры и давления. Он не имеет цвета, вкуса и запаха, поэтому его нередко используют в промышленности и научных исследованиях
- Плотность: Плотность азота составляет около 1,25 г/см³ при нормальных условиях температуры и давления (0°C, 1 атм).
- Температура плавления и кипения: Азот плавится при температуре около -210°C и кипит при температуре около -196°C.
- Теплоемкость: Теплоемкость азота составляет около 29.1 Дж/(моль·К) при постоянном давлении.
- Теплопроводность: Теплопроводность азота составляет около 0.0254 Вт/(м·К) при 0°C.
Из-за своих физических свойств азот часто используется в различных областях, таких как промышленность, медицина и научные исследования. Например, азот используется для замораживания и сохранения пищевых продуктов, охлаждения электронной техники, создания инертной атмосферы при сварке и пайке, а также в процессе производства аммиака и других химических соединений.






