
Когда рассматриваются химические реакции, часто используется метод полуреакций, чтобы более подробно и точно описать процесс. Одной из таких реакций является реакция между йодом (I2) и гидроксидом натрия (NaOH), которая приводит к образованию йодида натрия (NaI), нитрата натрия (NaNO3) и воды (H2O). Чтобы составить уравнение реакции методом полуреакций, сначала нужно разбить процесс на две части: окисление и восстановление. В результате окисления йод переходит в йодат, а восстановление происходит на месте гидроксида натрия. Подставив оба процесса в уравнение реакции, можно получить полное описание происходящей химической реакции.
Метод полуреакций для уравнения реакции I2+NaOH NaI + NaIO3+H2O

- Определите, какие вещества окисляются, а какие восстанавливаются. В данном случае иод (I2) окисляется, а гидроксид натрия (NaOH) восстанавливается.
- Запишите полуреакцию окисления и полуреакцию восстановления для каждого вещества. Для окисления I2 полуреакция будет выглядеть следующим образом: I2 -> 2I- (уравнение 1). Для восстановления NaOH полуреакция будет выглядеть следующим образом: 2OH- -> H2O + 2e- (уравнение 2).
- Сбалансируйте полуреакции по атомам, кроме кислорода и водорода. В уравнении 1 у нас уже сбалансировано по атомам, поэтому мы оставляем его таким же. В уравнении 2 мы добавляем к 2OH- еще 2H2O для сбалансирования кислорода: 2OH- -> H2O + 2H2O + 2e- (уравнение 2).
- Сбалансируйте полуреакции по электронам, выровняв количество электронов в обоих полуреакциях. В уравнении 1 у нас нет электронов, поэтому мы оставляем его без изменений. В уравнении 2 у нас 2e- на правой стороне, поэтому мы добавляем еще 2e- к уравнению 1: I2 + 2e- -> 2I- (уравнение 1).
- Сложите оба уравнения полуреакций вместе. I2 + 2e- -> 2I- (уравнение 1) + 2OH- -> H2O + 2H2O + 2e- (уравнение 2).
- Отмените одинаковые электроны на обеих сторонах уравнения. Получим окончательное уравнение: I2 + 2OH- -> 2I- + H2O + 2H2O + 2e-.
Таким образом, метод полуреакций позволяет нам балансировать сложные уравнения реакций, разбивая их на отдельные полуреакции и последовательно сбалансировав их. Этот метод особенно полезен при работе с окислительно-восстановительными реакциями, где происходит передача электронов между веществами.
Описание метода полуреакций
Затем мы можем отбалансировать каждую полуреакцию по отдельности, и в конечном итоге сложить их в правильном соотношении. Это делает метод полуреакций очень удобным и позволяет нам более точно и эффективно балансировать реакции.
Возьмем, к примеру, уравнение реакции:
I2 + NaOH → NaI + NaIO3 + H2O
Чтобы применить метод полуреакций, мы должны сначала определить, какие вещества окисляются, а какие восстанавливаются. В данном случае, иод (I2) окисляется, а гидроксид натрия (NaOH) восстанавливается.
Мы можем записать полуреакции следующим образом:
Окисление:
- I2 → 2I—
Восстановление:
- 2OH— → H2O + O2-
Теперь мы можем отбалансировать каждую полуреакцию по количеству атомов вещества, с которым происходит реакция. В данном случае, нам необходимо умножить полуреакцию окисления на 2 и полуреакцию восстановления на 1 для того, чтобы выровнять количество атомов.
Окисление:
- 2I2 → 4I—
Восстановление:
- 4OH— → 2H2O + O2-
Теперь, когда полуреакции отбалансированы, мы можем сложить их вместе, чтобы получить окончательное уравнение реакции:
2I2 + 4OH— → 4I— + 2H2O + O2-
Чтобы упростить это уравнение, можно убрать O2- с обеих сторон, так как это является внешним зрителем и не принимает участия в реакции:
2I2 + 4OH— → 4I— + 2H2O
И вот у нас есть окончательно отбалансированное уравнение реакции с помощью метода полуреакций.
Метод полуреакций может быть весьма полезен для балансировки сложных реакций и обеспечивает более точные и эффективные результаты.
Уравнение реакции I2+NaOH NaI + NaIO3+H2O
Рассмотрим реакцию между йодом (I2) и гидроксидом натрия (NaOH), которая приводит к образованию йодида натрия (NaI), перйодата натрия (NaIO3) и воды (H2O). Мы можем разбить эту реакцию на две полуреакции, чтобы лучше понять процесс:
- Полуреакция окисления: 2I- -> I2 + 2e-
- Полуреакция восстановления: 2OH- -> H2O + 2e-
Теперь мы можем сложить эти две полуреакции и получить общую реакцию:
- 2I- + 2OH- -> I2 + H2O + 2e-
- 2OH- + I2 -> I2 + H2O + 2e-
- 2I- + 2OH- + I2 -> I2 + NaI + H2O + NaIO3
Таким образом, уравнение реакции I2 + NaOH -> NaI + NaIO3 + H2O можно записать следующим образом:
- 2NaOH + I2 -> NaI + NaIO3 + H2O
Эта реакция является окислительно-восстановительной, так как в ней происходит одновременное окисление йода и восстановление гидроксида натрия.
Итак, полученное уравнение реакции показывает, что при взаимодействии йода с гидроксидом натрия образуются йодид натрия, перйодат натрия и вода. Эта реакция особенно интересна и полезна в области химии и учебного процесса.
Разделение реакции на полуреакции
Первый шаг состоит в определении окислителя и восстановителя в реакции. Окислитель — это вещество, принимающее электроны, а восстановитель — вещество, отдающее электроны. На этом этапе полезно обратить внимание на изменения в оксидационных состояниях элементов и выделение кислорода или водорода. Окислитель и восстановитель находятся на разных сторонах уравнения реакции.
Затем следует разделить реакцию на полуреакции для окислителя и восстановителя. Полуреакции показывают изменения в окислительных состояниях элементов и передачу электронов.
При записи полуреакций, окисление обозначается в качестве отдельной реакции, а восстановление — в другой. В полуреакциях также указываются коэффициенты стехиометрии для веществ и электронов.
Затем полуреакции сбалансировываются для обеспечения сохранения массы и заряда. Сначала сбалансировываются все элементы, кроме водорода и кислорода, затем сбалансировываются электроны и, наконец, вода и водород.
После балансировки полуреакций и проверки, что заряд и масса сбалансированы, полуреакции комбинируются обратно в одну реакцию с учетом правильных коэффициентов перед полуреакциями.
Разделение реакции на полуреакции позволяет систематически и обоснованно балансировать химические уравнения. Этот метод также позволяет определить количество передаваемых электронов и провести анализ электрохимических процессов.
Балансировка полуреакций и окончательное уравнение реакции
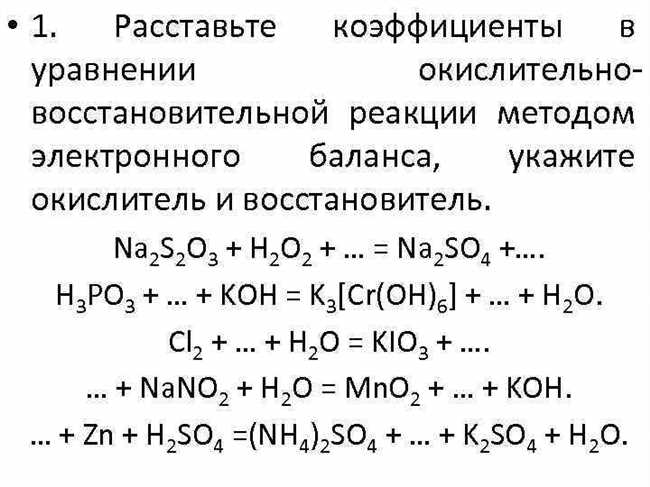
Для сбалансированной полуреакции необходимо равенство суммарных зарядов и числа атомов каждого элемента в начальном и конечном состоянии. Затем полученные полуреакции объединяются, сокращая общие реагенты и продукты.
В случае уравнения реакции I2 + NaOH → NaI + NaIO3 + H2O методом полуреакций, можно разделить реакцию на две полуреакции:
- Окислительная полуреакция: I2 → 2I—
- Восстановительная полуреакция: 2NaOH → NaI + NaIO3 + H2O
Далее необходимо сбалансировать каждую полуреакцию, обеспечивая равенство числа атомов и зарядов на обоих сторонах каждого уравнения. После этого, объединив две полуреакции, мы получим окончательное сбалансированное уравнение реакции.
Окончательное уравнение реакции будет выглядеть следующим образом:
1) 2I— + 2NaOH → NaI + NaIO3 + H2O
2) I2 + 2NaOH → 2I— + H2O
3) I2 + 2NaOH → NaI + NaIO3 + H2O
Таким образом, метод полуреакций позволяет балансировать уравнения реакций, сохраняя консервацию массы и заряда, и получать окончательное сбалансированное уравнение реакции.






