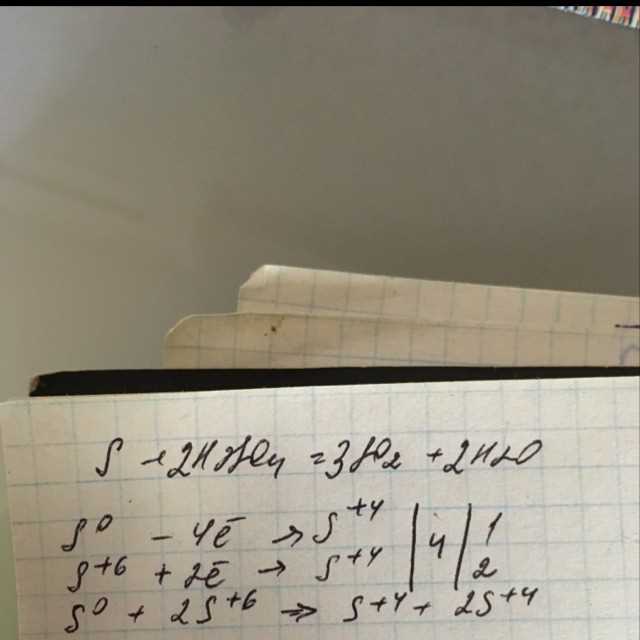
Когда мы изучаем химию, важно уметь уравнивать химические реакции. Одной из наиболее распространенных реакций является взаимодействие серы (S) с серной кислотой (H2SO4), при котором образуется диоксид серы (SO2) и вода (H2O). Чтобы уравновесить эту реакцию, мы можем использовать метод электронного баланса.
Метод электронного баланса основан на законе сохранения массы и заряда. Он предполагает, что в химической реакции количество атомов каждого элемента и сумма зарядов должны быть одинаковыми до и после реакции. Чтобы уравновесить данную реакцию, нам нужно сбалансировать количество атомов серы и водорода в обоих реагентах и продуктах.
После уравнивания реакции, мы можем записать уравнение реакции в более простой и понятной форме, которая показывает, какие вещества участвуют в реакции и в каких пропорциях. Это позволяет нам лучше понять процесс химической реакции и использовать эту информацию в других аспектах химии.
Реакция S + H2SO4 в SO2 + H2O
Давай рассмотрим реакцию между S (сера) и H2SO4 (серной кислотой), которая приводит к образованию SO2 (диоксида серы) и H2O (воды). Когда сера встречается с серной кислотой, воздушка наполняется запахом сероводорода (H2S), но в данном случае образуется диоксид серы и вода.
Интересно, почему эта реакция привлекает так много внимания? Ну, во-первых, реакция между серой и серной кислотой может быть использована в различных промышленных процессах, таких как производство серной кислоты, оксида цинка и других веществ. Кроме того, эта реакция играет важную роль в решении проблемы загрязнения окружающей среды, связанной с выбросами сернистого газа.
Теперь возвращаемся к электронному балансу. Представьте себе, что у вас есть электронные весы, способные измерять массу атомов. Когда вы помещаете атом серы в одну чашу весов и серную кислоту в другую, весы показывают, что один атом серы и одна молекула серной кислоты переходят в одну молекулу диоксида серы и одну молекулу воды.
Почему это так важно? Ну, с помощью электронного баланса мы можем увидеть, что в данной реакции атом серы «теряет» 2 электрона, а молекула серной кислоты «забирает» эти электроны, становясь диоксидом серы и водой. Это позволяет нам определить, как именно происходит химическая реакция.
Таким образом, реакция между серой и серной кислотой приводит к образованию диоксида серы и воды, и электронный баланс позволяет нам лучше понять, как именно это происходит. Используя эту информацию, мы можем улучшить промышленные процессы и защитить окружающую среду.
Итак, теперь ты знаешь о красивой и важной реакции между серой и серной кислотой. Я надеюсь, что тебе интересно узнавать больше о мире химии и открытиях, которые оправдывают эту захватывающую науку. Приятного изучения!
Описание реакции
Рассмотрим конкретную реакцию: S + H2SO4 -> SO2 + H2O.
- Определяем степени окисления всех элементов в веществах до и после реакции.
- В данной реакции сера (S) имеет степень окисления 0, а в серной кислоте (H2SO4) сера имеет степень окисления +6.
- Часто водород (H) имеет степень окисления +1, но в данном случае водород в серной кислоте имеет степень окисления +4.
- Кислород (O) в воде (H2O) имеет степень окисления -2.
- Элемент серы (S) в начальных веществах имеет степень окисления 0, а в конечных веществах — степень окисления +4, значит его степень окисления увеличилась.
- Для компенсации увеличения степени окисления серы (S) добавляем соответствующее количество электронов в левой части реакции.
- Теперь балансируем остальные элементы: водород (H) и кислород (O).
- Пересчитываем степени окисления всех элементов в конечных веществах: сера (S) имеет степень окисления +4, водород (H) — степень окисления +1, а кислород (O) в водороде — степень окисления -2.
- Сравниваем сумму степеней окисления до и после реакции
- Определяем количество электронов, необходимых для уравнивания окислительно-восстановительных реакций.
- Теперь можно записать уравнение реакции, балансируя количество атомов и зарядов.
- Проверяем баланс уравнения: сумма степеней окисления всех элементов должна быть одинаковой до и после реакции.
- В нашем случае уравнение реакции будет выглядеть следующим образом: 2S + 6H2SO4 -> 2SO2 + 8H2O.
Итак, мы успешно уравняли реакцию S + H2SO4 -> SO2 + H2O, используя метод электронного баланса. Этот метод позволяет нам балансировать сложные химические реакции, сохраняя законы сохранения массы и энергии. Он широко применяется в химических исследованиях, а также в промышленности для производства различных продуктов и веществ.
Необходимость уравнивания реакции
Основная задача уравнивания реакции состоит в том, чтобы число атомов каждого элемента было одинаковым в обоих сторонах реакции. Это позволяет подсчитать количество веществ, участвующих в реакции, а также определить атомную и молекулярную массу реагентов и продуктов.
Неуравненную реакцию невозможно использовать для проведения расчетов или получения конкретных результатов. Все химические уравнения должны быть сбалансированы и содержать одинаковое количество атомов каждого элемента. Иначе, результаты могут быть неверными и не соответствовать реальной химической реакции.
Уравнивание реакции также позволяет определить стехиометрические коэффициенты, которые указывают, сколько молекул каждого реагента необходимо для формирования определенного количества продукта. Это важная информация при проведении лабораторных экспериментов и производстве химических веществ.
Кроме того, уравниванная реакция позволяет легко анализировать химические реакции и предсказывать их характеристики, такие как тепловые эффекты или изменение pH. Изучение уравненных реакций позволяет химикам исследовать различные аспекты химии и разрабатывать новые методы синтеза и преобразования веществ.
Метод электронного баланса: уравнивание реакции S + H2SO4 в SO2 + H2O

Метод электронного баланса основан на принципе сохранения электронов в химической реакции. В процессе реакции электроны передаются от одного вещества к другому, при этом общее число электронов остается неизменным. Это позволяет нам уравнять реакцию, используя коэффициенты перед формулами веществ.
Возьмем, к примеру, реакцию S + H2SO4 → SO2 + H2O. Наша задача — выяснить, как нужно уравнять эту реакцию, чтобы число атомов каждого элемента было одинаковым до и после реакции.
Прежде всего, посмотрим на атом серы (S). Он встречается только в одном веществе — в сере (S), итак, уравняем его сначала. Так как у нас один атом серы на левой стороне реакции, и он должен быть одинаковым и на правой, то ставим коэффициент перед формулой серы (S) — 1.
Теперь давайте посмотрим на серную кислоту (H2SO4). У нее на левой стороне реакции два атома водорода (H), а на правой только один. Чтобы уравнять их, поставим перед формулой водорода (H2) коэффициент 2, а перед серной кислотой (H2SO4) — 2.
Теперь перейдем к диоксиду серы (SO2). У него на левой стороне реакции атом серы (S) уже уравнен, поэтому перейдем к атомам кислорода (O). На левой стороне реакции у нас 4 атома кислорода (O) (2 из серной кислоты (H2SO4) и 2 из воды (H2O)), а на правой — только 2 атома кислорода (O) в диоксиде серы (SO2). Для уравнивания атомов кислорода (O) наравне, проставим перед формулой воды (H2O) коэффициент 2.
Осталось убедиться, что наша уравненная реакция соблюдает принцип сохранения электронов. Для этого можешь воспользоваться электронным балансом и проверить, что число переданных и принятых электронов на левой и правой сторонах реакции совпадает.
Таким образом, уравнение реакции будет выглядеть следующим образом: S + 2H2SO4 → 3SO2 + 2H2O.
А ты заметил, как поэтапно и логично мы уравнивали реакцию, следуя методу электронного баланса? Надеюсь, теперь у тебя нет затруднений с уравниванием химических реакций. Если у тебя есть еще вопросы, не стесняйся задавать! Удачи в изучении химии!
Процесс уравнивания реакции
Для уравнивания реакции S + H2SO4 -> SO2 + H2O с помощью метода электронного баланса, мы должны рассмотреть изменение окислительного состояния каждого атома ионов вещества.
В данной реакции атом серы в начальном состоянии имеет окислительное состояние 0, в то время как вещество SO2 (диоксид серы) имеет окислительное состояние +4. Таким образом, атом серы в реакции S -> SO2 подвергается окислению. Соответственно, другие атомы ионы вещества подвергаются восстановлению.
Чтобы уравнять реакцию, мы можем добавить следующие коэффициенты перед формулами веществ:
- 1 перед S
- 2 перед H2SO4
- 1 перед SO2
- 2 перед H2O
В результате уравненной реакции получаем:
S + 2H2SO4 -> SO2 + 2H2O
Теперь реакция сбалансирована и удовлетворяет закону сохранения массы и заряда.
Уравнивание реакции является важной частью изучения химии, поскольку позволяет лучше понять и предсказывать химические процессы. Кроме того, этот метод может быть полезен при разработке новых химических реакций и материалов.
Решение уравнения
Метод электронного баланса позволяет уравнять химические реакции, основываясь на передаче электронов. Для реакции S + H2SO4 → SO2 + H2O необходимо решить уравнение и определить коэффициенты перед каждым веществом.
Применяя метод электронного баланса, мы можем установить, что сера (S) имеет окислительное состояние 0, а серная кислота (H2SO4) имеет окислительное состояние +6. При реакции сера окисляется, а серная кислота восстанавливается, поэтому необходимо выравнять количество электронов на обеих сторонах уравнения.
Используя рассмотрение окислительных и восстановительных реагентов, мы можем предложить следующее уравнение:
- 2S + 3H2SO4 → 3SO2 + 2H2O + 2H2О
В данном уравнении сера окисляется до окислительного состояния +4, а серная кислота восстанавливается до окислительного состояния +4.
Таким образом, метод электронного баланса помогает решить уравнение реакции S + H2SO4 → SO2 + H2O и вывести правильные коэффициенты перед веществами.






