- Кальций в простом веществе
- Символ и химические свойства кальция
- Физические свойства кальция
- 1. Химическая активность
- 2. Физическое состояние
- 3. Проводимость электричества
- 4. Пламя
- 5. Растворимость
- 6. Важность для здоровья
- Химическая связь в простом веществе
- Ионная связь
- Ковалентная связь
- Металлическая связь
- Основной вид химической связи в кальции
- Структура и свойства химической связи в кальции
- Электронная структура кальция
Кальций – это элемент, который играет важную роль во многих физиологических процессах организма. Он является основным компонентом костей и зубов, помогает в проведении нервных импульсов, участвует в сокращении мышц и регулирует уровень некоторых гормонов. В природе кальций может находиться в виде простого вещества, т.е. одиночных атомов. Основной тип химической связи в простом веществе кальция – ионная связь. Кальций имеет тенденцию с отдавать свои два электрона во внешней энергетической оболочке, что приводит к образованию иона Ca2+. Ионная связь сопровождается притяжением между положительно заряженными катионами кальция и отрицательно заряженными анионами других элементов, что обеспечивает стабильность и прочность соединения.
Кальций в простом веществе
Кальций представляет собой металл, который обладает серебристым оттенком. Он относится к щелочноземельным металлам и химический символ его – Ca. Кальций является пятиместным элементом в периодической таблице Менделеева и находится во втором периоде и второй группе.
Кальций в простом веществе образует кубическую кристаллическую решётку, кристаллы которого могут иметь различные формы. Он обладает металлическим блеском и хорошей термопроводностью. При комнатной температуре кальций является твёрдым веществом, но при нагревании его можно перевести в жидкое состояние. Кальций обладает способностью реагировать с водой, образуя гидроксид кальция и выделяя водород.
- Атомный номер: 20
- Атомная масса: 40,08
- Плотность: 1,54 г/см³
- Температура плавления: 842 °C
- Температура кипения: 1484 °C
Кальций легко растворяется в растворителях, таких как вода и некоторые кислоты. Он является важным компонентом в производстве различных материалов, таких как стекло, цемент и керамика. Также кальций используется в пищевой промышленности, для приготовления пищевых добавок и подкислителей.
Необходимость кальция для нашего организма подчёркивается множеством исследований, которые свидетельствуют о его пользе для костной системы, здоровья сердца и нервной системы. Мы получаем кальций из пищи, такой как молоко и молочные продукты, рыба, орехи и зеленые овощи. Тем не менее, в некоторых случаях может потребоваться дополнительное потребление кальция в виде добавок или препаратов, поэтому перед их применением рекомендуется проконсультироваться с врачом.
Таким образом, кальций в простом веществе является важным элементом для нашего организма и широко используется в различных отраслях промышленности. Не забывайте о питательной ценности кальция и включайте продукты, богатые этим элементом, в свой рацион, чтобы поддерживать здоровье и силу своего организма.
Символ и химические свойства кальция

Кальций имеет серебристо-серый металлический блеск и хорошо проводит тепло и электричество. Он мягкий и пластичный металл, который можно легко отрезать ножом. Кальций также реагирует с водой, образуя гидроксид кальция и выделяя водород. Этот процесс может быть довольно впечатляющим, поскольку водород начинает выделяться в виде пузырьков и металл кипит внутри воды.
Одно из самых интересных свойств кальция — его способность реагировать со многими другими веществами. Например, кальций может реагировать с кислородом, выделяя много тепла и образуя оксид кальция. Эта реакция является одним из способов получения кальция в промышленных масштабах.
Кальций также является важным элементом для живых организмов, особенно для костей и зубов. Он присутствует в виде кальциевых соединений, таких как гидроксиапатит, которые придают костям и зубам их прочность и твердость. Кальций также играет важную роль в передаче нервных импульсов и сокращении мышц.
В общем, кальций — это важный элемент с множеством интересных свойств. Он не только служит строительным материалом для костей и зубов, но и является ключевым игроком во многих химических реакциях в природе и в организме человека. Без кальция наше тело не могло бы функционировать должным образом. Поэтому не забывайте побаловать свое тело кальцием, употребляя продукты, богатые этим элементом, такие как молоко, сыр и йогурт.
Физические свойства кальция
1. Химическая активность
Кальций — чрезвычайно активный металл, который реагирует с большинством неметаллов. Он легко соединяется с кислородом, нитрогеном и серой. Это делает его одним из самых реактивных металлов в периодической системе элементов.
Например, кальций может образовывать оксид кальция (CaO), который является основным компонентом известь для производства цемента и строительных материалов.
2. Физическое состояние
Кальций — серебристо-серый металл, который можно нарезать ножом. Он имеет плотность около 1,55 г/см³ и температуру плавления около 842°C (1548°F).
Также интересно отметить, что кальций является относительно мягким металлом и легко разделить его на тонкие проволоки или прутки.
3. Проводимость электричества
Кальций обладает хорошей проводимостью электричества. Это свойство делает его очень полезным для различных электрических приложений.
Например, кальций используется в изготовлении электродов для электролиза алюминия и магния, а также в производстве батарей и аккумуляторов.
4. Пламя
Еще одно интересное свойство кальция — его способность вызывать яркое оранжевое пламя при сжигании. Поэтому этот металл часто используется в пиротехнике и для создания спецэффектов в кино и театре.
Попробуйте представить, какой потрясающий зрелищный эффект можно получить, добавив кальций в огонь!
5. Растворимость
Кальций растворяется в кислотах, таких как соляная кислота, но плохо растворим в воде. В то же время, соли кальция, такие как хлорид кальция и нитрат кальция, хорошо растворимы в воде.
Такая растворимость кальция в различных средах делает его полезным для производства различных химических соединений и продуктов.
6. Важность для здоровья
Как мы уже знаем, кальций играет важную роль в нашем организме. Он является строительным материалом для костей и зубов, помогает сократить мышцы и передавать нервные импульсы. Также кальций влияет на свертываемость крови и функцию многих ферментов.
Поэтому употребление достаточного количества кальция в пищу очень важно для поддержания здоровья наших костей и общего благополучия.
Таким образом, кальций — удивительный элемент, который обладает разнообразными физическими свойствами. Эти свойства делают его полезным и важным как в наших жизнях, так и в различных отраслях промышленности.
Химическая связь в простом веществе
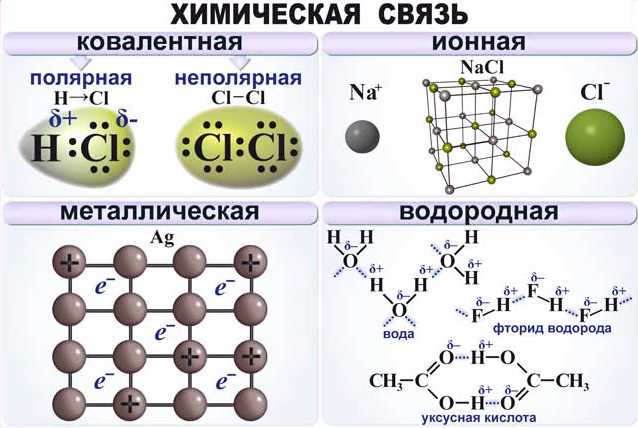
В простом веществе химическая связь возникает между атомами одного вида химического элемента. В зависимости от свойств и структуры этих атомов, химическая связь может быть различной. Однако, основными видами химической связи являются ионная связь, ковалентная связь и металлическая связь.
Ионная связь
Ионная связь образуется между атомами, которые обмениваются электронами, образуя положительно и отрицательно заряженные ионы. Она характерна для веществ, состоящих из металлов и неметаллов.
Примером ионной связи является кристаллическая решетка соли – хлорида натрия (NaCl). В этом соединении атом натрия отдает один электрон атому хлора, образуя положительный ион Na+ и отрицательный ион Cl-. Эти ионы притягиваются друг к другу и образуют прочную и стабильную связь.
Ковалентная связь
Ковалентная связь возникает между атомами, которые совместно используют электроны. Атомы образуют пару электронов, называемую связью или долей, которая обеспечивает их устойчивость.
Молекула воды (H2O) является примером ковалентной связи. Два атома водорода (H) делят одну пару электронов с атомом кислорода (O), образуя молекулу воды, в которой оба водородных атома и атом кислорода связаны между собой совместно используемыми электронами.
Металлическая связь
Металлическая связь возникает между атомами металла и характеризуется свободным передвижением электронов между атомами. Фактически, электроны в материале распределены по всей структуре, образуя «электронное облако».
Прочный металл, такой как железо (Fe), образует металлическую связь. В металле атомы железа располагаются близко друг к другу и создают общую сеть электронов, которые легко передвигаются по материалу. Благодаря этой связи, металлы обладают высокой теплопроводностью и электропроводностью.
В итоге, химическая связь в простом веществе может быть ионной, ковалентной или металлической, в зависимости от свойств атомов и их взаимодействия. Понимание этого позволяет лучше понять строение и свойства различных веществ, а также применить эту информацию в различных отраслях науки и промышленности.
Основной вид химической связи в кальции
Кальций обладает многочисленными химическими свойствами, но его основной вид химической связи — ионная связь. Ионная связь возникает между атомами, когда один или несколько из них отдают или получают электроны. В случае кальция, он обладает двумя электронами в внешней энергетической оболочке и готов отдать их.
Кальций имеет электронную конфигурацию 1s2 2s2 2p6 3s2. Последние два электрона находятся в валентной энергетической оболочке, и он готов отдать их, чтобы стать ионом с двумя положительными зарядами Ca2+. Этот ион принимает участие в образовании множества соединений.
К примеру, кальций может образовывать ионные связи с атомами хлора (Cl), кислорода (O) и другими элементами. В результате образуются соединения, такие как хлорид кальция (CaCl2) и оксид кальция (CaO), которые являются структурными компонентами вещества.
Ионная связь в кальции обусловлена его устремленностью отдать электроны и сформировать положительный ион. Это позволяет ему взаимодействовать с отрицательно заряженными атомами других элементов и создавать стабильные и сильные связи.
Совместно с другими элементами, кальций играет роль в различных биологических процессах, таких как в костях и зубах, в регулировании мышечной активности и свертываемости крови. Он также является важным питательным элементом для растений, способствует их росту и развитию.
Структура и свойства химической связи в кальции
Структура кальция представляет собой кристаллическую решетку, в которой каждый атом кальция окружен шестью атомами кислорода, образуя октаэдрический комплекс. Эта структура позволяет кальцию образовывать прочную химическую связь с другими элементами, что делает его идеальным для строительства костей и зубов.
Свойства химической связи в кальции обусловлены его электронной конфигурацией. Кальций имеет две электронные оболочки — K и L. Внешняя электронная оболочка содержит два электрона в s-орбитали, которые легко отдаются или принимаются другими атомами. Этот процесс называется ионизацией и позволяет кальцию образовывать ион Ca2+.
Ион Ca2+ обладает положительным зарядом и притягивает отрицательно заряженные ионы или атомы с большими свободными электронными парами, такие как кислород. В результате образуется ионная связь, в которой кальций и другие элементы образуют химическую связь за счет притяжения положительного и отрицательного зарядов. Это делает кальций стабильным и прочным веществом.
Однако химическая связь в кальции не является строго ионной. В некоторых случаях, особенно при образовании соединений с элементами со средней электроотрицательностью, возникает ионно-кавалентная связь. В таких случаях электроны принадлежат обоим атомам и образуют общие электронные облака. Это придает кальцию и его соединениям некоторые характеристики связи, типичные для ковалентной связи.
Кальций имеет также способность образовывать координационные связи с молекулами, содержащими атомы с парами электронов. Это свойство позволяет кальцию образовывать комплексы с различными органическими и неорганическими соединениями. Например, кальций играет важную роль в функционировании нервной системы и мышц благодаря образованию комплексов с белками и другими молекулами, которые участвуют в передаче сигналов и сокращении мышц.
Электронная структура кальция
На первом энергетическом уровне кальция находятся 2 электрона. На втором энергетическом уровне располагаются 8 электронов, а на третьем — 8. Остальные 2 электрона расположены на четвертом энергетическом уровне.
Все электроны внешнего энергетического уровня кальция составляют его валентную оболочку. Это важно, поскольку валентные электроны отвечают за химические свойства кальция. Валентная оболочка кальция также включает s-подуровень, который имеет форму сферы и может содержать до 2 электронов.
Электронная структура кальция можно представить следующим образом:
| Энергетический уровень | Подуровень | Количество электронов |
|---|---|---|
| 1 | 1s | 2 |
| 2 | 2s | 2 |
| 2 | 2p | 6 |
| 3 | 3s | 2 |
| 3 | 3p | 6 |
| 4 | 4s | 2 |
Электронная структура кальция позволяет ему образовывать исключительно стабильные соединения. Кальций обладает полной валентной оболочкой и способен вступать в реакции с другими элементами, чтобы сбалансировать свою зарядовую нейтральность путем передачи или получения электронов.
Электронная структура кальция является основой для его химической активности и обусловливает его роль в жизни организмов, а также в промышленных процессах.






