
Когда мы говорим о растворении металлов в кислотах, в первую очередь вспоминаются такие металлы, как цинк и алюминий. Но на самом деле список металлов, способных растворяться в кислотах, намного шире. Взаимодействие металлов и кислот основывается на химической реакции, приводящей к образованию солей и выделению водорода.
Некоторые металлы, такие как железо, медь и свинец, могут растворяться в различных кислотах. Например, железо может растворяться в соляной, серной и азотной кислотах. Медь может растворяться в серной и азотной кислотах, а свинец – в уксусной кислоте.
Важно помнить, что растворимость металлов в кислотах зависит от их химической активности, концентрации кислоты и других факторов. Это может быть полезной информацией при работе с металлами и кислотами.
Металлы, способные растворяться в кислотах
Не все металлы имеют способность растворяться в кислотах. Некоторые из них полностью растворяются, другие реагируют только частично, а третьи вообще не реагируют.
Вот список некоторых металлов, которые способны растворяться в кислотах:
- Цинк (Zn): Реакция цинка с кислотой приводит к образованию соли и выделению водорода. Цинк обычно реагирует с сильными минеральными кислотами, такими как серная (H2SO4) или соляная (HCl).
- Железо (Fe): Железо может реагировать с некоторыми кислотами, оставаясь в растворе в виде ионов Fe2+ или Fe3+. Это важное свойство железа используется в различных химических процессах и промышленности.
- Алюминий (Al): Алюминий реагирует с некоторыми кислотами, образуя соль и выделяяся водород. Однако он также обладает защитной плёнкой оксида, которая может предотвратить его дальнейшую реакцию с кислотой.
- Магний (Mg): Магний реагирует с кислотами, образуя соль и выделяяся водород. Это свойство обусловлено высокой активностью металла.
Реакция металлов с кислотами может происходить очень быстро или медленно, в зависимости от условий. Также стоит отметить, что разные кислоты могут взаимодействовать с металлами по-разному.
Интересно, что реакция металлов с кислотами может происходить не только в химической лаборатории, но и в повседневной жизни. Например, когда мы употребляем пищу, содержащую кислоты, такие как лимонный сок, в нашем организме происходят реакции, где металлы (например, кальций) растворяются.
Важно помнить, что реакция металлов с кислотами может быть опасной и требует аккуратности и знания правил безопасности.
Общие сведения
Металлы могут растворяться в кислотах, так как они реагируют с химическими компонентами кислоты, образуя ионы металла и соответствующие соли. Растворение металлов в кислотах может происходить с разной скоростью и с различными образованиями продуктов реакции в зависимости от свойств и концентрации кислоты.
Важно отметить, что не все металлы растворяются в кислотах одинаково. Некоторые металлы, такие как золото и платина, являются химически инертными и практически не реагируют с большинством кислот. В то же время, другие металлы, такие как железо и цинк, реагируют с некоторыми кислотами, обжигаясь в процессе и образуя ионы металла и газы.
Растворение металлов в кислотах может использоваться в различных процессах и промышленных приложениях. Например, серная кислота используется для получения сульфатов металлов, таких как медь и цинк. Соляная кислота может использоваться для очистки и обработки металлов, таких как сталь и алюминий. Некоторые кислоты, такие как нитратная кислота, могут использоваться в различных электрохимических процессах для получения металлов и соединений.
В зависимости от свойств металлов и концентрации кислоты, процесс растворения может быть обратимым или необратимым. Обратимая реакция означает, что металл может быть восстановлен из его соли, например, путем проведения электролиза или добавления соответствующего вещества. Необратимая реакция означает, что металл полностью растворяется в кислоте, и его восстановление не является простым процессом.
Ниже приведена таблица, демонстрирующая некоторые металлы и их поведение в кислотах:
| Металл | Реакция с кислотой |
|---|---|
| Железо | Реагирует с соляной кислотой, выделяя водород |
| Цинк | Реагирует с соляной кислотой, выделяя водород |
| Алюминий | Реагирует с соляной кислотой, образуя соль и выделяя водород |
| Медь | Не реагирует с соляной кислотой |
В итоге, растворение металлов в кислотах является важным физико-химическим процессом, который имеет широкий спектр применений в различных отраслях промышленности и науки.
Реакция металлов с кислотами
Процесс реакции металла с кислотой связан с переходом электронов от металла к кислороду кислоты. Когда металл вступает в контакт с кислотой, образуется ион металла и ион водорода. Это происходит потому, что активные металлы обладают способностью отдавать электроны, тогда как кислоты имеют способность принимать электроны. Таким образом, реакция между металлом и кислотой является окислительно-восстановительной реакцией.
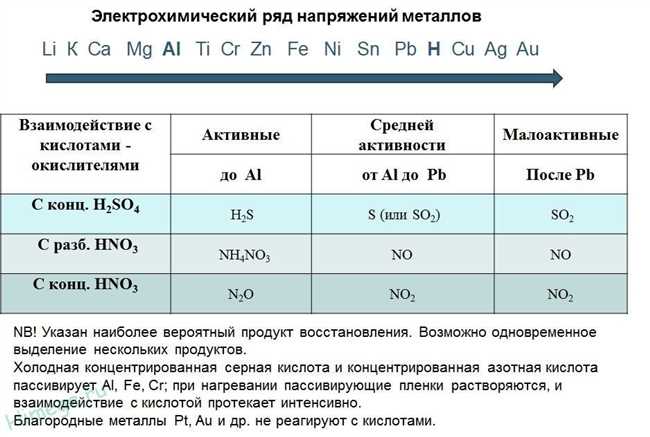
Реактивность металлов зависит от их положения в ряду активности металлов. Активные металлы, такие как натрий, калий и магний, могут растворяться в большинстве кислот, включая соляную, серную и азотную кислоты. Для таких реакций характерно выделение водорода и образование соответствующих металлических солей.
Менее активные металлы, такие как железо, цинк и алюминий, реагируют только с сильными кислотами, такими как хлороводородная и серная кислоты. При этом образуются соли этих металлов и выделяется водород. Некоторые металлы, такие как серебро и золото, не реагируют с кислотами при обычных условиях.
Важно отметить, что некоторые металлы, такие как железо, могут реагировать с кислородом из воздуха, образуя окислы металла, вместо образования солей кислоты. Это явление наблюдается, например, при образовании ржавчины на поверхности железа.
Сам по себе процесс реакции металлов с кислотами представляет как научный, так и практический интерес. Он помогает понять химические свойства различных элементов, а также имеет практическое применение в разных областях, включая производство металлических солей, батарей и других электрохимических устройств.
Примеры реакций металлов с кислотами:
- Цинк (Zn) + серная кислота (H2SO4) → сернокислый цинк (ZnSO4) + водород (H2)
- Алюминий (Al) + соляная кислота (HCl) → хлорид алюминия (AlCl3) + водород (H2)
- Магний (Mg) + азотная кислота (HNO3) → нитрат магния (Mg(NO3)2) + водород (H2)
Такие реакции имеют важное значение в химии и являются одними из фундаментальных процессов, подтверждающих химическую активность и взаимодействие металлов с другими веществами.
Алкалные металлы
Когда алкалные металлы вступают в реакцию с кислотами, происходит образование солей и выделение водорода. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода:
2 Na + 2 HCl → 2 NaCl + H2
Эта реакция является хорошим примером растворения алкалиевых металлов в кислотах. Важно отметить, что кислоты способны растворять только металлы, обладающие достаточной реактивностью и электроотрицательностью. Алкалные металлы обладают этими свойствами и, следовательно, способны растворяться в кислотах.
Кроме того, алкалные металлы проявляют свою реактивность и вступают в реакцию с водой. Реакция натрия с водой, например, приводит к образованию гидроксида натрия и выделению водорода:
2 Na + 2 H2O → 2 NaOH + H2
Эти реакции показывают, что алкалные металлы не только растворяются в кислотах, но и в воде, что делает их еще более интересными для исследования и использования в различных приложениях.
Переходные металлы

Одной из причин, по которой переходные металлы растворяются в кислотах, является их способность образовывать комплексные соединения с кислотой. Когда они растворяются в кислотах, они могут образовывать ионы металла, которые образуют комплексы с ионами водорода в кислоте.
Какие именно переходные металлы растворяются в кислотах, зависит от типа кислоты. Например, железо может растворяться в соляной кислоте, но не растворяется в серной кислоте. Никель, с другой стороны, может растворяться в серной кислоте, но не растворяется в соляной кислоте. Это обусловлено различием в химической реактивности переходных металлов и их способностью образовывать комплексы соединения с различными кислотами.
Таким образом, переходные металлы могут растворяться в кислотах благодаря своей способности образовывать комплексные соединения с ионами водорода в кислоте. Это является важным свойством переходных металлов и активно используется в различных химических процессах и промышленных приложениях.
Заключение
Драгоценные металлы, такие как золото, серебро и платина, обладают уникальными свойствами и используются в различных сферах человеческой деятельности.
Золото является одним из самых ценных драгоценных металлов и широко используется для создания ювелирных изделий, монет, электроники и медицинского оборудования. Его устойчивость к окислению и высокая плотность делают его идеальным материалом для драгоценностей.
Серебро также широко применяется в ювелирной промышленности, а также в производстве фотопленок и электроники благодаря своей высокой электропроводности. Оно также имеет антибактериальные свойства и используется для создания медицинских приборов и поверхностей.
Платина является редким и дорогим металлом, который широко применяется в химической, автомобильной и электронной промышленности. Она обладает высокой устойчивостью к коррозии и способностью катализировать химические реакции.
Драгоценные металлы имеют высокую стоимость и важны для мировой экономики. Они являются символами роскоши и статуса, а также имеют практическое применение во многих областях науки и техники. Эти металлы остаются ценными и востребованными, и их использование продолжит развиваться и прогрессировать в будущем.






