Какая валентность может быть у хлора? Ответы и примеры
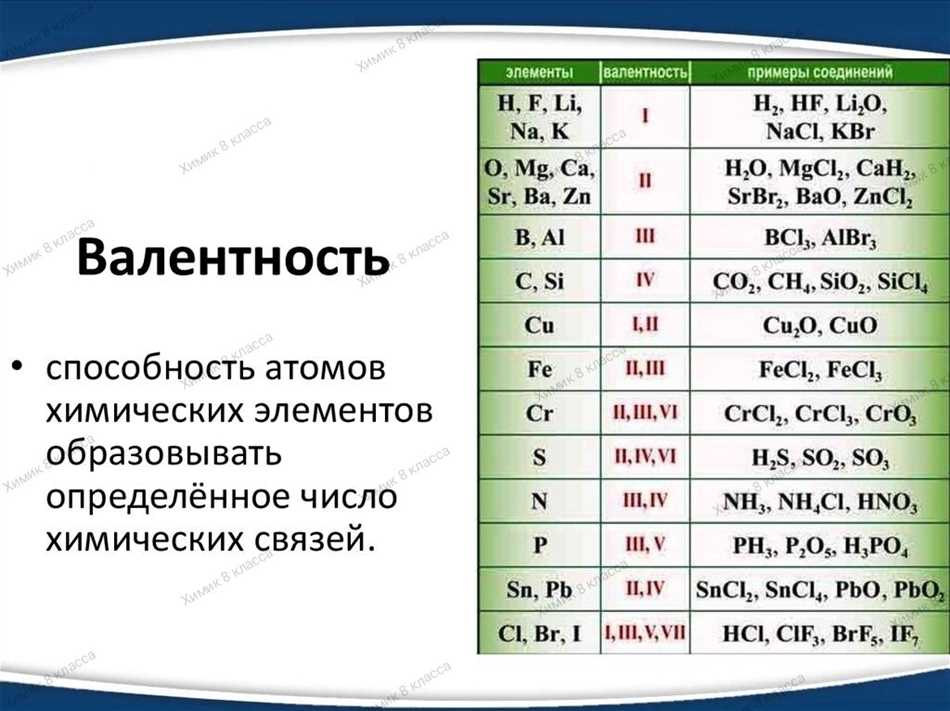
Хлор – химический элемент, который находится в группе галогенов периодической системы. Он имеет атомный номер 17 и обозначается символом Cl. Любопытно, что у хлора может быть различная валентность в химических соединениях. Основные валентности хлора -1, +1, +3, +5 и +7.
Валентность — это количество электронов, которые атом хлора может отдавать или принимать при образовании химических связей. Например, хлор может образовать одноцепочечную связь и принять один электрон, в результате чего он приобретает валентность -1. Однако, хлор может также образовывать сильные ковалентные связи и иметь положительную валентность, например, +3, +5 или даже +7 в соответствующих соединениях.
Ответы и примеры валентности хлора зависят от окружающих условий и других элементов, с которыми он вступает в реакцию. Изучение валентности хлора позволяет лучше понять его химические свойства и использование в различных промышленных и научных процессах.
Хлор
Химические свойства хлора
Хлор относится к группе галогенов и обладает атомным номером 17. Его атомная масса составляет около 35,5 атомных единиц. Это значит, что атом хлора имеет 17 протонов в ядре и обычно имеет 17 электронов, чтобы сохранить электрическую нейтральность.
Главной особенностью хлора является его высокая реакционная способность. Он способен образовывать соединения с многими другими элементами, в том числе с металлами и неметаллами. Это делает его важным сырьем для различных отраслей промышленности.
Хлор широко используется в производстве множества продуктов, от бытовых и промышленных химикатов до пластика и полимеров. Он также активно применяется в процессе обеззараживания воды и бассейнов благодаря своим антимикробным свойствам.
Валентность хлора
Валентность — это количество электронов, которые элемент может принять или отдать во время химической реакции. Она определяет способность элемента образовывать соединения с другими элементами.
Хлор имеет семь внешних электронов в своей валентной оболочке. Это означает, что он может принять один электрон от другого элемента, чтобы достичь электронной конфигурации аргона (18 электронов). Таким образом, хлор обычно имеет валентность -1.
Однако, в некоторых случаях хлор может также образовывать соединения с положительной валентностью. Например, в соединении хлора с кислородом (хлорат) он имеет валентность +5. Это связано с тем, что в данном соединении хлор делит пару электронов с кислородом, передавая ему из своей валентной оболочки.
Примеры соединений хлора
Хлор образует широкий спектр соединений с различными элементами. Вот несколько примеров таких соединений:
- Хлорид натрия (NaCl): это химическое соединение, которое мы обычно называем обычной столовой солью или поваренной солью. Она имеет валентность -1, поскольку хлор передает один электрон натрию.
- Хлорид кальция (CaCl2): это соединение, которое часто используется в медицине и промышленности. Оно имеет валентность -1 для хлора, так как каждый атом кальция принимает два электрона от двух отдельных атомов хлора.
- Хлорсеребро (AgCl): это осадок, который образуется при реакции хлорида серебра с другими соединениями. Он также имеет валентность -1 для хлора, так как серебро принимает один электрон от хлора.
Это лишь несколько примеров соединений хлора, которые встречаются в нашей повседневной жизни. Использование хлора в разных областях позволяет нам получать широкий спектр продуктов и материалов, которые нам необходимы.
Так что следующий раз, когда вы столкнетесь с продуктом или материалом, содержащим хлор, подумайте об этом элементе и его удивительных свойствах.
Определение и свойства хлора
Свойства хлора:
- Физические свойства: Хлор представляет собой желто-зеленый газ с характерным запахом, похожем на запах прочувствованный на бассейнах. Он имеет малую плотность и низкую температуру кипения и плавления.
- Химические свойства: Хлор является очень реактивным химическим элементом. Он способен образовывать соединения со многими другими элементами. Хлор может образовывать соли с многими металлами и может протекать реакции окисления-восстановления. Он также может дезинфицировать воду и быть использован в производстве пластиков и ряда других химических соединений.
Хлор встречается в природе в различных соединениях, таких как хлориды и хлораты. Большинство хлора, используемого в промышленности и в быту, производится путем электролиза растворов хлоридов, таких как натрия или калия хлориды.
Итак, ответ на вопрос о валентности хлора: хлор может иметь различные валентности в различных соединениях. Например, в хлориде натрия (NaCl), хлор имеет валентность -1, в хлорате натрия (NaClO3), хлор имеет валентность +5. Таким образом, валентность хлора может варьироваться от -1 до +7 в различных соединениях.
Валентности хлора
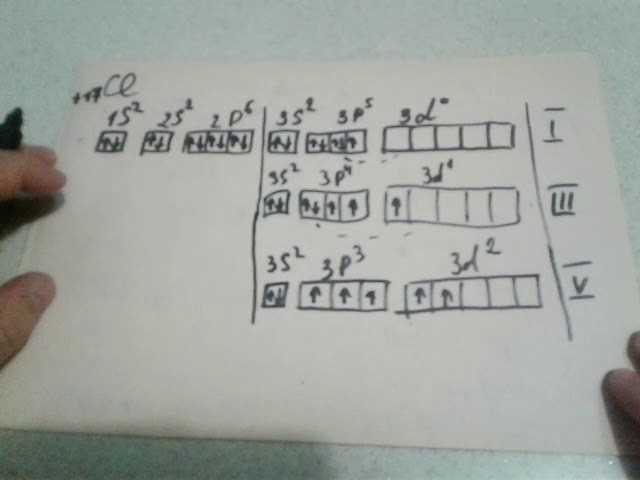
Хлор может образовывать соединения с различными валентностями в зависимости от окружающих условий. Наиболее распространенные валентности хлора -1, +1, +3, +5 и +7.
Одной из самых распространенных форм хлора является ион хлорида (Cl-), в котором хлор имеет валентность -1. Это означает, что хлор отдает один электрон, чтобы стать зарядовым отрицательным ионом. Ионы хлорида находятся во многих соединениях, таких как хлорид натрия (NaCl) и хлорид калия (KCl).
В некоторых соединениях хлор может иметь валентность +1, такую как в хлориде гидрогена (HCl), где он отдает один электрон водороду. Другими примерами хлора с валентностью +1 являются соединения между хлором и металлами, такие как хлорид меди (CuCl).
Валентность +3 наблюдается в соединениях хлора с некоторыми металлами, такими как алюминий и железо. Один из примеров такого соединения — хлорид алюминия (AlCl3), в котором хлор образует три ковалентные связи с алюминием.
Две важные валентности хлора, +5 и +7, обычно встречаются в его оксидах и кислотах. Хлор имеет валентность +5 в соединениях, таких как хлорат натрия (NaClO3), где он образует пятикратные связи с кислородом. Валентность +7 наблюдается в перхлорате (ClO4-), где хлор образует семикратные связи с кислородом.
В конечном счете, валентность хлора будет зависеть от конкретного соединения и его окружения. Химия хлора весьма разнообразна и позволяет ему образовывать широкий спектр химических соединений.
Примеры соединений с различными валентностями хлора
Примеры соединений с различными валентностями хлора включают:
- Хлорид (Cl-) — валентность хлора равна -1. Примеры хлоридов включают хлорид натрия (NaCl), хлорид калия (KCl) и хлорид кальция (CaCl2). Хлориды используются в пищевой промышленности, медицине и других областях.
- Хлор (Cl2) — валентность хлора равна 0. Хлор используется в качестве дезинфицирующего средства в бассейнах, для производства пластмасс, ртутных ламп и других продуктов.
- Хлорат (ClO3-) — валентность хлора равна +5. Примером хлората является хлорат калия (KClO3), который используется в пиротехнике.
- Хлорит (ClO2-) — валентность хлора равна +4. Хлорит натрия (NaClO2) используется в процессах отбеливания и в производстве бумаги.
- Гипохлорит (ClO-) — валентность хлора равна +1. Гипохлорит натрия (NaClO) широко используется в качестве дезинфицирующего средства и отбеливающего агента.
Это лишь несколько примеров соединений с различными валентностями хлора. Хлор формирует многочисленные соединения с другими элементами и может иметь различные валентности в зависимости от химического окружения.
Если у вас есть какие-либо вопросы о химических соединениях и валентности хлора, не стесняйтесь задавать их в комментариях!
Влияние валентности хлора на его свойства и использование

Наиболее распространенными валентностями хлора являются -1, +1, +3, +5 и +7. Когда хлор имеет валентность -1, он образует ион хлорида (Cl-) и находится в стабильном состоянии. Это значительно влияет на его растворимость и реакционную способность, так как ион хлорида является негативно заряженным.
Хлор с положительной валентностью также используется в различных химических реакциях и процессах. Например, хлор с валентностью +1 применяется в производстве хлорида натрия (NaCl), который широко используется в пищевой промышленности и других отраслях. Валентность +3 используется для получения белого порошка, известного как хлорокс (ClO2), который используется в качестве дезинфицирующего средства и отбеливателя.
- Отрицательная валентность хлора также играет важную роль в озоновом слое Земли. Хлорфторуглероды (Фреоны), содержащие хлор, могут разрушать озон, что приводит к тонкому озоновому слою и увеличению ультрафиолетового излучения на поверхности Земли.
- Валентность хлора может быть использована для получения различных соединений и материалов, включая пластиковые полимеры, дезинфицирующие средства, промышленные реагенты и многое другое.
- Использование разных валентностей хлора позволяет создавать разнообразные продукты, а также контролировать их свойства и характеристики. Это открывает широкие возможности в области разработки новых материалов и технологий.
В целом, валентность хлора играет важную роль в химической промышленности, медицине, пищевой промышленности и других отраслях. Его свойства и использование зависят от выбранной валентности, что позволяет получить широкий спектр продуктов и материалов.






