
Как составить ионное молекулярное уравнение: подробное руководство
Ионные молекулярные уравнения являются важным инструментом в химических расчетах, позволяющим представить реакцию в виде расщепления на ионы и молекулы. Составить ионное молекулярное уравнение может быть сложно на первый взгляд, но с правильным подходом это осуществимо.
В этом подробном руководстве я расскажу вам, как составить ионное молекулярное уравнение с помощью нескольких простых шагов. Вы узнаете, как определить ионы, учитывать их заряд и сбалансировать уравнение. Я также поделюсь с вами полезными советами, которые помогут вам легче разобраться в этом процессе.
Независимо от вашего уровня знаний в химии, это руководство поможет вам стать более уверенными в составлении ионных молекулярных уравнений. Так что давайте начнем!
Определение ионного молекулярного уравнения
В ионном молекулярном уравнении каждая ионная формула и суммарный заряд каждой ионной формулы записываются вместе с правильным коэффициентом стехиометрии, показывающим отношение числа молекул или ионов, затрагиваемых в реакции.
Ионное молекулярное уравнение намного точнее и подробнее, чем простое химическое уравнение, которое показывает только входящие и выходящие вещества и не учитывает особенности ионного состава. Оно позволяет более полно описывать происходящую реакцию и понять, какие ионы и молекулы фактически участвуют в образовании новых веществ.
Примером ионного молекулярного уравнения может быть реакция между хлоридом натрия и серной кислотой, которая приводит к образованию хлороводорода и сульфата натрия:
NaCl + H2SO4 → HCl + Na2SO4
В этом уравнении видно, что хлорид натрия (NaCl) и серная кислота (H2SO4) реагируют и образуются хлороводород (HCl) и сульфат натрия (Na2SO4). Ионные формулы, заряды и коэффициенты стехиометрии правильно отображены.
Ионные молекулярные уравнения имеют широкое применение в химических реакциях и помогают ученым лучше понимать и изучать процессы, происходящие на молекулярном и ионном уровне. Они также помогают предсказывать результаты реакций и определять необходимые условия для их прохождения.
Шаг 1: Запись сбалансированного уравнения
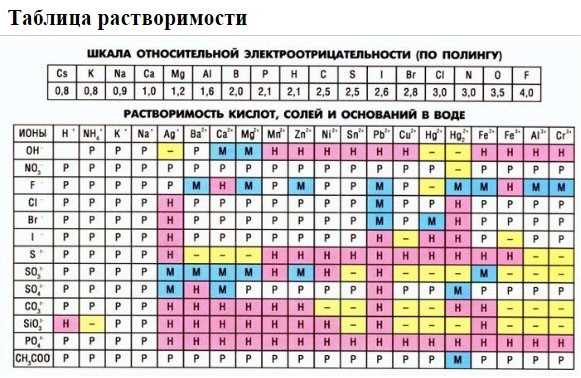
Сбалансированное уравнение химической реакции должно учитывать сохранение количества атомов каждого элемента на обеих сторонах уравнения. Это важно для обеспечения соблюдения закона сохранения массы, который гласит, что масса реагентов должна быть равна массе продуктов.
Когда мы говорим о ионном молекулярном уравнении, мы учитываем ионы, которые присутствуют в реакции. Ионы — это заряженные атомы или группы атомов. Они могут быть положительными (катионами) или отрицательными (анионами).
Например, давайте рассмотрим реакцию между хлоридной кислотой (HCl) и гидроксидом натрия (NaOH), которая приводит к образованию хлорида натрия (NaCl) и воды (H2O).
Сбалансированное уравнение для этой реакции будет выглядеть следующим образом:
- HCl + NaOH → NaCl + H2O
В данном случае, обе стороны уравнения содержат один атом водорода, один атом кислорода и один атом натрия. Это значит, что количество атомов каждого элемента остается неизменным на обеих сторонах уравнения.
Важно заметить, что сбалансированное уравнение не только отражает количество атомов каждого элемента, но и имеет равное количество положительных и отрицательных зарядов на обеих сторонах уравнения. Это также помогает обеспечить соблюдение закона сохранения заряда.
Составление ионного молекулярного уравнения может быть сложным процессом, требующим определенных знаний о реакциях и ионах. Однако, с практикой и пониманием основных принципов, вы сможете легко записывать сбалансированные уравнения ионных молекул.
Шаг 2: Разложение реагентов на ионы
Прежде всего, давайте вспомним определение электролитов. Электролиты — это вещества, которые могут проводить электрический ток в растворе или плавящемся состоянии. Обычно электролиты являются солями, кислотами или щелочами.
Когда электролиты растворяются в воде или плавятся, они диссоциируют на положительно и отрицательно заряженные ионы. Например, соль NaCl вводит в раствор ионы Na+ и Cl-. А кислота HCl диссоциирует на ионы H+ и Cl-.
Чтобы разложить реагенты на ионы, вам нужно знать тип реагента и его способность диссоциировать. Обратите внимание на формулу реагента и исследуйте, является ли он солью, кислотой или щелочью. Если реагент является электролитом, разложите его на положительно и отрицательно заряженные ионы.
Например, рассмотрим молекулу HCl. Кислоты обычно диссоциируют в воде, поэтому HCl может быть разложен на ион H+ (катион) и ион Cl- (анион). Таким образом, в ионном молекулярном уравнении для реакции, в которой участвует HCl, вы можете записать ионы H+ и Cl- вместо молекулы HCl.
Важно отметить, что не все реагенты разлагаются на ионы. Например, некоторые молекулы, такие как сахар (C6H12O6), не разлагаются на ионы и не являются электролитами. В таких случаях вы можете оставить молекулярную формулу реагента в ионном молекулярном уравнении.
Таким образом, во втором шаге составления ионного молекулярного уравнения вы разлагаете реагенты на ионы, учитывая их способность диссоциировать. Это поможет вам понять, какие ионы участвуют в реакции и какие ионы образуются в результате.
Шаг 3: Запись ионного молекулярного уравнения

После того, как вы определили ионы, участвующие в реакции, и их заряды, вы готовы записать ионное молекулярное уравнение. Это уравнение показывает, какие ионы реагируют и какими соединениями образуются.
Чтобы записать ионное молекулярное уравнение, следуйте этим шагам:
- Напишите формулы реагентов слева от стрелки. Реагенты должны быть записаны в виде ионов, а не в виде молекул.
- Расставьте коэффициенты перед формулами так, чтобы число атомов каждого элемента с обеих сторон уравнения было одинаковым.
- Напишите формулы продуктов справа от стрелки. Продукты также должны быть записаны в виде ионов, а не в виде молекул.
- Снова расставьте коэффициенты перед формулами, чтобы число атомов каждого элемента с обеих сторон уравнения было одинаковым.
Ионное молекулярное уравнение должно отражать баланс атомов и зарядов. Это означает, что сумма зарядов ионов с обеих сторон уравнения должна быть одинаковой.
Зная шаги и принципы записи ионного молекулярного уравнения, вы сможете правильно представить реакции между ионами и составить уравнение. Это позволит вам лучше понять подобные химические процессы и предсказывать результаты реакций.






