
Как подобрать коэффициенты: K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Данный химический уравнение описывает реакцию окисления сульфида калия (K2S) калийным перманганатом (KMnO4) в кислой среде с образованием серы (S), сульфата марганца (MnSO4), сульфата калия (K2SO4) и воды (H2O). Подбор правильных коэффициентов перед веществами в химическом уравнении является ключевым шагом в решении данной задачи.
Нам необходимо определить, какое количество каждого вещества участвует в реакции и уравнять реакцию, чтобы количество атомов каждого элемента с обоих сторон уравнения было одинаковым.
Что такое коэффициенты?

Когда мы говорим о химических реакциях, важно понимать, что реагенты реагируют друг с другом и образуют продукты. Вроде простого математического уравнения, не так ли? Но здесь есть некоторые особенности…
Все начинается с записи химических формул для каждого вещества, присутствующего в реакции. Затем в уравнении реакции мы указываем количество молекул или атомов каждого вещества с помощью коэффициентов. Это помогает нам соблюдать закон сохранения массы, который гласит, что масса реагентов должна равняться массе продуктов.
Замечательно, правда? Но как мы выбираем эти коэффициенты? Как мы решаем, сколько молекул каждого вещества участвует в реакции? Это может показаться сложным, но на самом деле это просто вопрос балансировки уравнения реакции.
Балансировка — это процесс, в котором мы изменяем коэффициенты перед формулами реагентов и продуктов, чтобы соблюсти закон сохранения массы. Мы можем изменять коэффициенты, но не можем менять подписи формул веществ.
Допустим, у нас есть уравнение реакции: K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O. Наша задача — найти правильные коэффициенты для балансировки этой реакции.
Следует отметить, что эта реакция, как и многие другие, является редокс-реакцией. В ней происходит окисление и восстановление атомов. Это может добавить сложности при выборе соответствующих коэффициентов.
Теперь, когда мы знаем, что такое коэффициенты и зачем они нужны, давайте начнем балансировку реакции K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O. Что мы можем сделать, это сначала балансировать атомы, а затем молекулы, чтобы получить правильные коэффициенты.
Значение и роль коэффициентов в химических уравнениях

Основная роль коэффициентов в химических уравнениях заключается в обеспечении сохранения массы и заряда в процессе реакции. Согласно закону сохранения массы, масса всех реагентов, превращающихся в продукты, должна быть равна массе этих продуктов. Коэффициенты позволяют нам настроить пропорции между реагентами и продуктами так, чтобы обеспечить сохранение массы.
Например, рассмотрим реакцию сгорания метана:
CH4 + 2O2 → CO2 + 2H2O
В этом уравнении коэффициенты 1 и 2 указывают на то, что для сгорания одной молекулы метана необходимо две молекулы кислорода, и в результате образуется одна молекула углекислого газа и две молекулы воды. Без этих коэффициентов уравнение будет неправильным и не отражает реального процесса сгорания метана.
Коэффициенты также играют важную роль в определении стехиометрического соотношения между реагентами и продуктами. Они показывают, в каких пропорциях вещества вступают в реакцию и какие соединения образуются в результате.
Например, в реакции диспропорционирования перекиси водорода:
2H2O2 → 2H2O + O2
Коэффициент 2 перед перекисью водорода указывает на то, что для реакции необходимо две молекулы перекиси водорода, и в результате образуется две молекулы воды и одна молекула кислорода.
Коэффициенты также позволяют нам рассчитывать количество вещества, вес или объем реагентов и продуктов, участвующих в реакции. Они являются ключевыми факторами при проведении химических расчетов и определении эффективности реакции.
Структура и состав уравнения
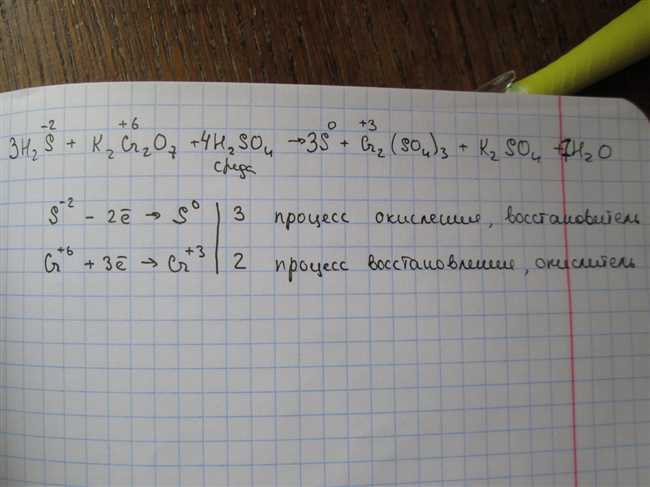
Уравнение реакции K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O можно разложить на составляющие:
- Реагенты:
- K2S — калийсульфид;
- KMnO4 — калий марганцовокислый;
- H2SO4 — серная кислота.
- Продукты реакции:
- S — сера;
- MnSO4 — сульфат марганца;
- K2SO4 — калийсульфат;
- H2O — вода.
Молекулярное уравнение реакции:
K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Из данного уравнения видно, что при взаимодействии калийсульфида (K2S) с калий марганцовокислым (KMnO4) и серной кислотой (H2SO4) образуется сера (S), сульфат марганца (MnSO4), калийсульфат (K2SO4) и вода (H2O).
В данном уравнении реакции коэффициенты перед формулами веществ показывают количество веществ, участвующих в реакции. Например, если у нас есть 2 молекулы калийсульфида, то перед K2S будет стоять коэффициент 2. Такая запись позволяет соблюдать закон сохранения массы и заряда.
Итак, структура и состав данного уравнения показывает нам, какие вещества взаимодействуют и какие продукты образуются в результате реакции.
Подбор коэффициентов при реакции с веществами K2S, KMnO4 и H2SO4
Во-первых, для начала анализируем все элементы в уравнении реакции. В данной реакции присутствуют K, S, Mn, O и H. Наша задача — сбалансировать уравнение таким образом, чтобы число каждого элемента в реагентах было равно числу этого элемента в продуктах.
Для начала разберемся с атомами калия (K). У нас есть 2 атома калия в K2S и 2 атома калия в K2SO4. Следовательно, коэффициенты для K2S и K2SO4 будут 1. Мы можем написать уравнение реакции следующим образом:
K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Теперь обратимся к атомам серы (S). У нас есть 1 атом серы в K2S и 1 атом серы в S. Значит, коэффициент для K2S будет 1.
Перейдем к атомам марганца (Mn). У нас есть 1 атом марганца в KMnO4 и 1 атом марганца в MnSO4. Следовательно, коэффициенты для KMnO4 и MnSO4 будут 1.
Далее рассмотрим атомы кислорода (O). У нас есть 4 атома кислорода в KMnO4, 1 атом кислорода в H2SO4 и 5 атомов кислорода в H2O. В реагентах имеем 4 + 1 = 5 атомов кислорода, следовательно, в продуктах также должно быть 5 атомов. Добавим коэффициенты 5 перед H2O и 2 перед K2SO4, чтобы сбалансировать количество атомов кислорода.
Осталось разобраться с атомами водорода (H). У нас есть 2 атома водорода в H2SO4 и 2 атома водорода в H2O. Так как число атомов водорода уже сбалансировано, коэффициенты для H2SO4 и H2O остаются 1.
Итоговое сбалансированное уравнение реакции выглядит следующим образом:
K2S + KMnO4 + H2SO4 = S + MnSO4 + 2K2SO4 + H2O
Таким образом, коэффициенты для данной реакции составляют: 1, 1, 1, 1, 1, 2, 1.
Надеюсь, данное объяснение помогло вам разобраться в процессе подбора коэффициентов при реакции с веществами K2S, KMnO4 и H2SO4. Если у вас остались вопросы или нужна дополнительная информация, не стесняйтесь обращаться!
Расчет и проверка правильности коэффициентов
Первым шагом при расчете коэффициентов является установление правильной стехиометрической формулы для каждого реагента и продукта. Далее следует сбалансировать количество атомов каждого элемента на обеих сторонах уравнения, используя коэффициенты.
После сбалансирования уравнения следует проверить правильность коэффициентов, удостоверившись, что сумма всех атомов каждого элемента на обоих сторонах уравнения совпадает. Это можно сделать путем подсчета числа атомов каждого элемента и сравнения результатов.
Для удобства проверки правильности коэффициентов можно использовать таблицу со счетчиком атомов каждого элемента. Поставив «+» перед каждым атомом, находим общее число атомов каждого элемента на левой стороне уравнения, и затем сравниваем его с числом атомов на правой стороне уравнения.
Таким образом, правильность коэффициентов в химическом уравнении «K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O» может быть проверена путем балансировки уравнения и сравнения числа атомов каждого элемента на обеих сторонах реакции.






