- Типы оксидов: кислотные, основные и амфотерные
- Кислотные оксиды
- Основные оксиды
- Амфотерные оксиды
- Итог
- Кислотные оксиды
- Основные оксиды
- Амфотерные оксиды
- Определение типа оксида
- 1. Определение химической формулы оксида
- 2. Определение электроотрицательности элементов
- 3. Анализ кислотно-основных свойств
- 4. Определение амфотерности оксида
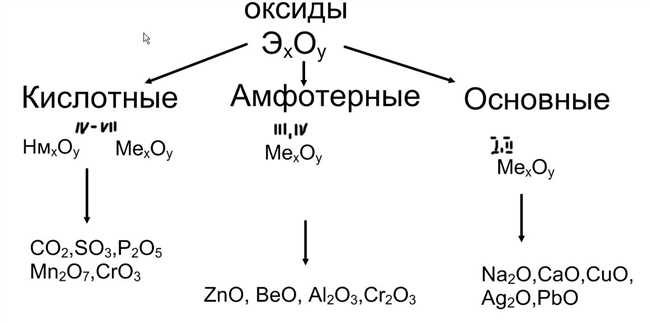
Когда мы говорим об оксидах, мы имеем в виду соединения элементов с кислородом. Оксиды могут быть кислотными, основными или амфотерными в зависимости от их реакции с водой. Определить тип оксида можно, исследуя его свойства и взаимодействие с водой.
Кислотные оксиды реагируют с водой, образуя кислоты. Они способны давать положительные ионы в растворе и обладают кислотными свойствами.
Основные оксиды, напротив, реагируют с водой, образуя основания. Они обладают способностью давать отрицательные ионы в растворе и обычно имеют щелочные свойства.
Амфотерные оксиды способны проявлять и кислотные, и основные свойства. Они могут реагировать и с кислотами, и с основаниями.
При изучении оксидов стоит обратить внимание на их химические свойства и реакции с водой, чтобы точно определить их тип.
Типы оксидов: кислотные, основные и амфотерные
Кислотные оксиды
Кислотные оксиды — это соединения, которые образуют кислоты при реакции с водой. Они содержат кислород и неметаллы. Примерами кислотных оксидов являются оксид серы (SO2), оксид азота (NO2) и оксид углерода (CO2).
Когда кислотные оксиды реагируют с водой, они образуют кислоты, которые обладают кислотными свойствами. Например, SO2 + H2O = H2SO3, где SO2 — кислотный оксид, а H2SO3 — серная кислота.
Основные оксиды
Основные оксиды — это соединения, которые образуют основания при реакции с водой. Они содержат кислород и щелочные металлы, такие как натрий, калий и магний. Примерами основных оксидов являются оксид натрия (Na2O), оксид калия (K2O) и оксид магния (MgO).
Когда основные оксиды реагируют с водой, они образуют основания, которые обладают щелочными свойствами. Например, Na2O + H2O = 2NaOH, где Na2O — основной оксид, а 2NaOH — гидроксид натрия.
Амфотерные оксиды
Амфотерные оксиды — это соединения, которые могут реагировать как с кислотами, так и с основаниями. Они содержат кислород и элементы, которые могут образовывать как кислоты, так и основания. Примерами амфотерных оксидов являются оксид алюминия (Al2O3) и оксид цинка (ZnO).
Например, Al2O3 + 6HCl = 2AlCl3 + 3H2O, где Al2O3 — амфотерный оксид, HCl — кислота, AlCl3 — соль алюминия.
Итог
Перечисленные типы оксидов — это основные классификации, которые помогают определить их химические свойства. Кислотные оксиды реагируют с водой, образуя кислоты, основные оксиды реагируют с водой, образуя основания, а амфотерные оксиды могут реагировать как с кислотами, так и с основаниями.
Это все о классификации оксидов. Теперь, когда вы знаете различия между кислотными, основными и амфотерными оксидами, вы можете легко определить их тип по их составу и химическим свойствам.
Кислотные оксиды
Кислотные оксиды — это соединения, которые образуются от соединения кислорода с неметаллами. Они обладают свойством реагировать с водой и образовывать кислоты. Интересно, не правда ли?
Наверное, ты хочешь знать, как определить кислотный оксид? Очень просто! Нужно лишь вспомнить одно важное правило: кислотный оксид обычно имеет высокую электроотрицательность. Он легко присоединяется к воде и образует кислоту.
Все это, конечно, звучит интересно, но я хотел бы поделиться с тобой некоторыми примерами кислотных оксидов. Таким образом, ты сможешь лучше разобраться в этом вопросе.
- Диоксид углерода (CO2) — это один из самых известных кислотных оксидов. Ты знаешь, что когда мы выдыхаем, то выбрасываем диоксид углерода? Это происходит потому, что диоксид углерода является кислотным оксидом, который реагирует с водой в наших легких и превращается в угольную кислоту.
- Сернистый газ (SO2) — еще один пример кислотного оксида. Он возникает при сжигании серы в присутствии воздуха. Когда этот газ взаимодействует с водой, образуется сернистая кислота.
- Оксид азота (NO2) — еще один кислотный оксид. Он образуется при сгорании топлива и присутствии высоких температур. Когда оксид азота реагирует с водой, образуется азотная кислота.
Теперь у тебя есть представление о кислотных оксидах. Надеюсь, что эта информация была полезной!
Основные оксиды
Сегодня мы поговорим о основных оксидах — классе оксидов, которые проявляют основные свойства. Они реагируют с водой, образуя щелочные растворы, и могут нейтрализовать кислоты.
Основные оксиды обычно состоят из металла и кислорода. Они имеют высокую основность из-за присутствия ионов гидроксида (ОН-) в своей структуре. Когда основный оксид вступает в реакцию с водой, происходит гидролиз, и ионы гидроксида освобождаются в раствор. Эта реакция приводит к образованию щелочной среды.
Некоторые из наиболее распространенных основных оксидов включают оксиды металлов, такие как кальций (CaO) — плотник известковый и натрий (Na2O) — плотник пищевой. Эти оксиды широко используются в различных отраслях промышленности, включая строительство, промышленное производство и пищевую промышленность.
- Кальций оксид (известь): используется в строительстве как компонент цемента и известковой штукатурки. Он также применяется в сельском хозяйстве для улучшения почвы.
- Натрий оксид: используется в пищевой промышленности для регулирования кислотности и консервации продуктов.
Что же касается свойств основных оксидов, они могут реагировать с кислотами, образуя соли. Например, когда оксид кальция реагирует с кислотой, образуется соль кальция и вода. Эта реакция называется нейтрализацией и является ключевым аспектом взаимодействия основных оксидов с кислотами.
Также следует отметить, что основные оксиды могут реагировать с кислородом, образуя перекисные соединения. Это особенно характерно для переходных металлов, таких как железо и медь.
Теперь, когда вы знаете больше о том, что такое основные оксиды, вы можете увидеть их важность в химии и их широкий спектр применений. Надеюсь, этот материал был для вас интересным и информативным! Если у вас есть какие-либо вопросы, не стесняйтесь задавать их.
Амфотерные оксиды
Амфотерные оксиды содержат в своей структуре одновременно и электроположительные, и электроотрицательные ионы. Благодаря этому они могут образовывать как кислотные соединения, так и основные соединения, в зависимости от среды, в которой они находятся.
Примером амфотерного оксида является оксид алюминия (Al2O3). Этот оксид может быть растворим в кислотах, например, в серной кислоте:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Он также может растворяться в щелочных растворах, образуя алюминаты:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Кроме оксида алюминия, к амфотерным оксидам относятся оксиды таких элементов, как цинк (ZnO), свинец (PbO), железо (Fe2O3) и многие другие.
Важно отметить, что амфотерные оксиды обладают рядом полезных свойств. Они могут использоваться в процессе нейтрализации кислот и оснований, а также для получения различных соединений, например, алюминия в доменном производстве или свинца при обработке руд.
Таким образом, амфотерные оксиды представляют особый класс веществ, способных проявлять и кислотные, и основные свойства, что делает их уникальными и широко применяемыми в различных областях науки и промышленности.
Определение типа оксида
1. Определение химической формулы оксида
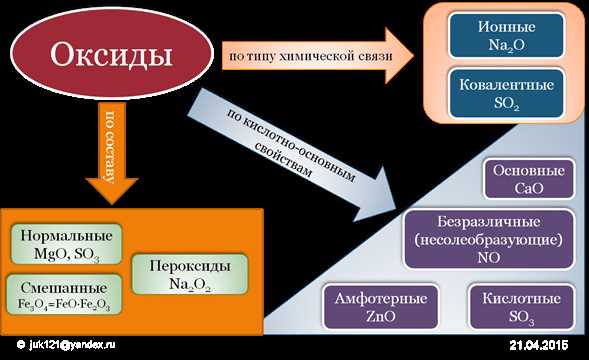
Первым шагом является определение химической формулы оксида. В ней обычно указывается соединяемый элемент и количество атомов кислорода. Например, SiO2 — это формула оксида кремния, а Fe2O3 — это формула оксида железа.
2. Определение электроотрицательности элементов
Далее необходимо определить электроотрицательность элементов, составляющих оксид. Электроотрицательность позволяет понять, какой элемент в оксиде будет проявлять кислотные или основные свойства.
3. Анализ кислотно-основных свойств

После определения электроотрицательности элементов, можно анализировать кислотно-основные свойства оксида. Если элемент с более высокой электроотрицательностью обладает анионическими свойствами, то оксид будет кислотным. Если же элемент с более низкой электроотрицательностью обладает катионическими свойствами, то оксид будет основным.
4. Определение амфотерности оксида
В некоторых случаях оксиды могут обладать амфотерными свойствами, что означает, что они могут взаимодействовать как с кислотами, так и с основаниями. Для определения амфотерности оксида, необходимо проанализировать его реакцию с кислотой и основанием.






