
Когда мы анализируем химические реакции, одним из важнейших аспектов является определение суммы коэффициентов, которые отображаются перед формулами реагентов и продуктов. Коэффициенты указывают на количество молекул, атомов или ионов, участвующих в реакции, и позволяют сбалансировать уравнение так, чтобы количество атомов каждого элемента находилось в равновесии с обеих сторон стрелки. Соответствующие коэффициенты могут быть определены путем использования различных методов, таких как метод инспекции, метод окислительно-восстановительных реакций или метод алгебраических уравнений. Зная правильную сумму коэффициентов, мы можем получить ясное представление о том, какие вещества преобразуются, сколько их и каким образом происходит химическая реакция.
Определение суммы коэффициентов химической реакции
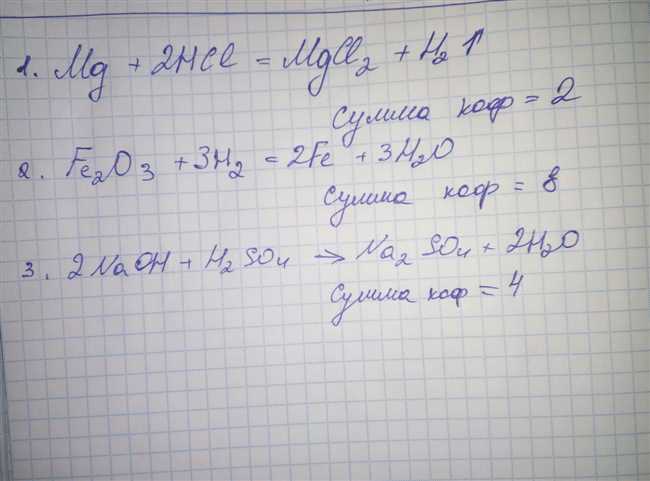
Для определения суммы коэффициентов химической реакции необходимо уравнять уравнение реакции, то есть сделать количество атомов каждого элемента одинаковым на обеих сторонах уравнения. Это позволяет соблюсти закон сохранения массы, который гласит, что масса реагирующих веществ должна быть равна массе образовавшихся продуктов.
В начале процесса уравнивания уравнения реакции можно использовать коэффициенты, обозначенные в уравнении, такие как 2, 3, 4 и т. д. Затем можно использовать метод инспекции, чтобы уравнять количество атомов каждого элемента на обеих сторонах. Этот метод заключается в анализе атомов каждого элемента и нахождении коэффициентов, которые делают количество атомов симметричным.
Метод инспекции обычно проще использовать для более простых уравнений, но для более сложных реакций может потребоваться использование алгоритма Гаусса-Жордана или метода балансировки по классу элементов.
Важно отметить, что сумма коэффициентов должна быть наименьшей возможной целочисленной величиной, чтобы отражать реальное соотношение между реагентами и продуктами.
Итак, определение суммы коэффициентов химической реакции включает в себя уравнивание уравнения реакции, чтобы соблюсти закон сохранения массы и обеспечить правильное соотношение между реагентами и продуктами. Это важный шаг в решении задач по химии и помогает понять, сколько молей каждого вещества участвует в реакции.
Определение исходных веществ
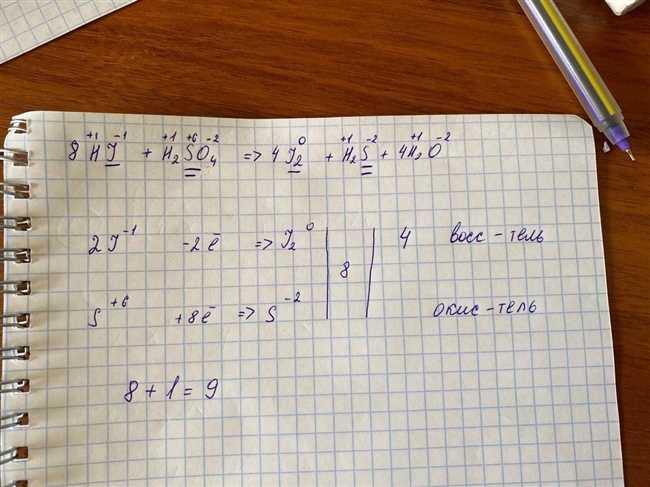
Для определения исходных веществ нужно изучить химическое уравнение реакции. Химическое уравнение — это способ записи химической реакции, который позволяет выразить соотношения между исходными веществами и продуктами. В уравнении указываются коэффициенты перед формулами веществ, которые показывают их количество в реакции.
Чтобы идентифицировать исходные вещества в химической реакции, нужно обратить внимание на вещества, которые претерпевают изменения и вступают в реакцию с другими веществами. Это обычно отражается в изменении химических формул исходных веществ. Если вы видите, что одно или несколько веществ в химическом уравнении заменяются другими веществами, то это могут быть исходные вещества.
- Изучаем химическое уравнение и обратим внимание на изменения веществ.
- Идентифицируем вещества, которые вступают в реакцию с другими веществами.
- Проверяем, какие из веществ претерпевают изменения по сравнению с начальной формулой.
- Определяем эти вещества как исходные вещества.
Важно отметить, что вещества, которые являются исходными в одной реакции, могут быть продуктами в другой реакции. Химические реакции могут быть взаимными и многосторонними, поэтому важно вести тщательный анализ химического уравнения и учитывать все возможности для определения исходных веществ.
Зная, как правильно определить исходные вещества, мы можем более точно анализировать и понимать химические реакции. Это важный навык, который поможет нам в дальнейшем изучении химии и применении ее знаний в практике.
Определение количества атомов в исходных веществах
Чтобы правильно определить сумму коэффициентов химической реакции, мы должны сначала рассмотреть количество атомов в исходных веществах. Это важный шаг, поскольку коэффициенты реакции должны отражать соотношение между исходными веществами и образующимися продуктами.
Для определения количества атомов в исходных веществах мы можем использовать химические формулы и таблицы элементов. Химические формулы дают нам информацию о том, сколько атомов каждого элемента присутствует в молекуле вещества. Например, формула H2O говорит нам, что в каждой молекуле воды присутствует 2 атома водорода и 1 атом кислорода.
Таблицы элементов химического элемента дополняют наши знания о составе элементов. Они предоставляют информацию о молярной массе каждого элемента и их атомных номерах. Молярная масса указывает нас на массу одного моля элемента, а атомный номер указывает на количество протонов в ядре атома.
Используя эту информацию, мы можем вычислить количество атомов каждого элемента в исходных веществах. Например, если у нас есть молекула H2O, мы знаем, что она содержит 2 атома водорода. Если мы имеем 4 молекулы H2O, то общее количество атомов водорода будет составлять 8.
Используйте эти методы, чтобы определить количество атомов каждого элемента в исходных веществах и далее правильно расставить коэффициенты реакции. Помните, что цель вашей работы — достичь баланса между исходными веществами и продуктами, чтобы сохранить закон сохранения массы и атомного числа.
Определение количества атомов в продуктах реакции
Когда мы изучаем химические реакции, нам часто требуется определить количество атомов, которые присутствуют в реагентах и продуктах реакции. Это важное умение, которое помогает нам понять, какие изменения происходят веществах во время реакции.
Для определения количества атомов в продуктах реакции, нам нужно знать коэффициенты стехиометрического уравнения реакции. Стехиометрическое уравнение показывает балансировку между реагентами и продуктами, указывая на их соотношение друг к другу.
Процесс определения количества атомов в продуктах реакции основан на принципе сохранения массы. Согласно этому принципу, масса реагентов до реакции должна быть равна массе продуктов после реакции. Это означает, что общее количество атомов в реагентах должно быть равно общему количеству атомов в продуктах.
Допустим, у нас есть уравнение реакции:
2H2 + O2 → 2H2O
В этом уравнении видно, что у нас есть 2 молекулы водорода (Н2) и 1 молекула кислорода (О2) в реагентах. После реакции, мы получаем 2 молекулы воды (Н2O) в качестве продукта.
Количество атомов водорода и кислорода определяется их коэффициентом в уравнении реакции. В данном случае, у нас есть 4 атома водорода (2 молекулы по 2 атома) и 2 атома кислорода (1 молекула по 2 атома) в реагентах. После реакции, мы имеем также 4 атома водорода (2 молекулы по 2 атома) и 2 атома кислорода (1 молекула по 2 атома) в продуктах.
Таким образом, мы можем определить количества атомов в продуктах реакции, используя коэффициенты стехиометрического уравнения.
Рассмотрим другой пример:
C6H12O6 + 6O2 → 6CO2 + 6H2O
В этом уравнении у нас есть 6 молекул глюкозы (C6H12O6) и 6 молекул кислорода (O2) в реагентах. После реакции, мы получаем 6 молекул углекислого газа (CO2) и 6 молекул воды (H2O) в качестве продуктов.
Таким образом, в продуктах реакции у нас также будет 6 молекул углекислого газа (CO2) и 6 молекул воды (H2O).
Таким образом, определение количества атомов в продуктах реакции является важной задачей, которая помогает нам понять, как происходят изменения веществ во время химической реакции. Правильное определение количества атомов в продуктах реакции обеспечивает точность и надежность результатов и позволяет нам более полно и глубоко исследовать и понимать химические явления.
Составление и сокращение реакционного уравнения
Для составления реакционного уравнения необходимо учесть законы сохранения вещества и энергии. Закон сохранения массы гласит, что масса реагентов должна быть равна массе продуктов реакции. Закон сохранения энергии показывает, что энергия в системе остается постоянной во время химической реакции.
Составление реакционного уравнения начинается с определения исходных веществ и их состава. Затем указываются коэффициенты, которые показывают количество молекул или атомов каждого вещества, участвующих в реакции. При этом необходимо учитывать балансировку уравнения, чтобы количество атомов каждого элемента в реагентах было равно количеству атомов этого элемента в продуктах.
Сокращение реакционного уравнения происходит путем устранения коэффициентов уравнения, сохраняя при этом баланс между реагентами и продуктами. Это позволяет увидеть и понять основную суть реакции и соотношение между веществами, участвующими в ней.
- Составление реакционного уравнения — важный этап изучения химической реакции.
- Законы сохранения массы и энергии должны учитываться при составлении уравнения.
- Составление уравнения начинается с определения исходных веществ и их коэффициентов.
- Сокращение уравнения позволяет увидеть основную суть реакции и соотношение между веществами.






