- Описание химического соединения КМnO4
- Состав и структура КМnO4
- Физические и химические свойства КМnO4
- Физические свойства КМnO4:
- Химические свойства КМnO4:
- Механизм определения степени окисления КМnO4
- Принципиальная схема определения степени окисления
- Реакции, используемые в определении степени окисления КМnO4
- Реакция с медным (II) иономи
- Реакция с водородсульфитом натрия
- Реакция с октавалентным аммонием фосфатом
- Подготовка растворов и необходимых реагентов
- Необходимые реагенты
- Подготовка растворов

Калий марганат(VII) или КМnO4 — одно из самых мощных окислителей, которое широко используется как реактив в химическом анализе и лабораторной практике. Определение степени окисления КМnO4 является важным шагом в анализе различных веществ и соединений.
Для определения степени окисления КМnO4 можно использовать несколько методов, включая титрование с помощью оксидоредукторных реакций, визуальное определение по цвету или использование спектрофотометрии. Каждый из этих методов имеет свои преимущества и ограничения, и выбор определенного метода зависит от конкретных условий и объекта исследования.
В данном руководстве мы рассмотрим подробный подход к определению степени окисления КМnO4 с использованием титрования и оксидоредукторных реакций. Этот метод позволяет точно определить количество КМnO4 в реакционной смеси и веществе, с которым оно взаимодействует.
Описание химического соединения КМnO4
Калий перманганат обладает ярким фиолетовым цветом и может присутствовать в виде кристаллов или порошка. Он растворяется в воде, образуя насыщенный раствор с интенсивным фиолетовым оттенком. Это свойство делает его удобным для использования в аналитической химии и медицине.
КМnO4 широко применяется в качестве окислителя. Он может окислять различные вещества, включая органические и неорганические соединения. Калий перманганат обладает способностью пребразовываться в марганатную кислоту (MnO4— → MnO42-) в отношении других более слабых окислителей.
В медицине КМnO4 используется как антисептик и дезинфицирующее средство. Он может быть использован для лечения различных заболеваний кожи, таких как экзема и инфекции. Кроме того, калий перманганат используется для лечения ран, ожогов и язв, благодаря его способности уничтожать бактерии и грибки.
Также КМnO4 применяется в процессе очистки воды. Он может удалять из воды различные загрязнения, включая органические вещества, железо, марганец и другие примеси. Калий перманганат активно используется в водоочистных сооружениях для обеспечения чистой питьевой воды.
В сельском хозяйстве КМnO4 используется для борьбы с грибковыми заболеваниями растений. Он может быть применен для обработки почвы, опрыскивания растений и внесения в систему орошения.
Итак, КМnO4 — это многоцелевой химический соединение, которое нашло применение в различных областях, включая аналитическую химию, медицину, водоочистку и сельское хозяйство. Его способность к окислению и антисептические свойства делают его ценным ресурсом для решения различных проблем и задач.
Состав и структура КМnO4
Структура КМnO4 состоит из ионов калия (K+) и перманганата (MnO4—). Ионы калия являются положительно заряженными и находятся вокруг отрицательно заряженного иона перманганата. Ион перманганата, seinerseits, структурирован в виде тетраэдра, состоящего из четырех атомов кислорода и одного атома марганца в центре.
Точная структура КМnO4 можно представить следующим образом:
| Химическая формула | Структура |
|---|---|
| KMnO4 |  |
Фиолетовый цвет КМnO4 обусловлен способностью ионов перманганата поглощать свет в видимой области спектра. Это делает КМnO4 отличным индикатором, который может быть использован для определения степеней окисления в других веществах.
Структура КМnO4 обладает высокой стабильностью и химической инертностью при обычных условиях. Однако, подвергаясь нагреванию или смешиванию с определенными веществами, он может легко разложиться, выделяя кислород и образуя другие соединения марганца.
В целом, КМnO4 является важным соединением с широким спектром применений. Знание его состава и структуры помогает понять его свойства и использовать его эффективно в различных областях науки и технологии.
Физические и химические свойства КМnO4
Физические свойства КМnO4:

- Окраска: КМnO4 обладает яркой фиолетовой окраской, что делает его хорошо заметным и различимым;
- Твердое вещество: КМnO4 находится в виде темно-фиолетовых кристаллов, которые легко растворяются в воде;
- Растворимость: КМnO4 обладает высокой растворимостью в воде, поэтому образуется насыщенный раствор с множеством применений;
- Разлагается при нагревании: КМnO4 разлагается при нагревании до температуры около 240°C, выделяя кислород;
- Взаимодействует с органическими веществами: КМnO4 обладает окислительными свойствами и может взаимодействовать с органическими веществами, проявляя высокую химическую активность.
Химические свойства КМnO4:
- Окислитель: КМnO4 является сильным окислителем и может окислять различные вещества, например, С2H5OH (этиловый спирт) окисляется до уксусной кислоты (CH3COOH);
- Антибактериальное действие: КМnO4 обладает антибактериальными свойствами, поэтому часто используется в медицине для обработки ран и дезинфекции;
- Используется в аналитической химии: КМnO4 широко используется в аналитической химии для определения содержания веществ, таких как железо;
- Применяется в органическом синтезе: КМnO4 может быть использован в органическом синтезе для получения различных соединений, например, окислению бензола до бензойной кислоты.
Таким образом, КМnO4 обладает рядом уникальных физических и химических свойств, которые делают его полезным и важным в различных областях науки и промышленности. Узнать его степень окисления можно с помощью определенных методов и реакций, которые детально описаны в руководствах и литературе.
Механизм определения степени окисления КМnO4
Калий марганат (КМnO4) — одно из наиболее распространенных соединений, используемых для определения степени окисления. Зная структуру этого соединения, мы можем определить степень окисления каждого атома.
Механизм определения степени окисления КМnO4 основан на следующих принципах:
- Кислород (O) всегда имеет степень окисления -2, за исключением случаев, когда он находится в пероксидных соединениях (тогда его степень окисления равна -1).
- Калий (K) всегда имеет степень окисления +1.
Таким образом, когда мы знаем степень окисления кислорода (-2) и калия (+1), мы можем определить степень окисления марганца (Mn) в КМnO4. Для этого мы используем следующий подход:
- Определим общую степень окисления в КМnO4. Сумма степеней окисления всех атомов в соединении должна быть равна нулю (поскольку соединение несет нейтральный заряд).
- Зная, что кислород имеет степень окисления -2 и калий +1, вычислим степень окисления марганца.
Для этого можем использовать формулу:
Степень окисления Mn = (Сумма степеней окисления остальных элементов) — (Сумма степеней окисления кислорода и калия)
Таким образом, используя этот механизм, мы можем определить степень окисления марганца в КМnO4 или любом другом соединении, содержащем марганец и кислород.
Принципиальная схема определения степени окисления
Определение степени окисления химического соединения, включая КМnO4, осуществляется на основе его структуры и учета количества окислителя и вещества, которое окисляется. Для определения степени окисления КМnO4, следует рассмотреть его состав и возможные реакции, которые он может претерпевать.
Калий марганат (КМnO4) состоит из иона калия (K+) и иона марганца (MnO4-). При этом ион марганца имеет степень окисления +7, так как марганец находится в самом высоком окислительном состоянии. Изначально ион марганца находится в виде MnO4- (марганатный ион).
Определение степени окисления КМnO4 может быть выполнено путем осмысленного и последовательного применения ряда химических реакций.
- Сперва, раствор КМnO4 окисляется одним из веществ, например, серной кислотой (H2SO4). При этом ион марганца снижает свою степень окисления до +6 в виде иона марганчевой кислоты (HMnO4).
- Второй шаг включает образование иона мангана с меньшей степенью окисления. Например, ион мангана с окислительным состоянием +2. Для этого, избыток иона сернистого ангидрида (SO2) в растворе приводит к образованию иона мангана с окислительным состоянием +2 (Mn2+).
- Третий шаг включает окисление иона мангана с окислительным состоянием +2 до окислительного состояния +4 при помощи иона кислорода из воздуха. В результате образуется ион мангана с окислительным состоянием +4 (MnO2).
Определение степени окисления КМnO4 завершается, когда манган окисляется до окислительных состояний, меньших +4.
Таким образом, схема определения степени окисления КМnO4 может быть представлена следующим образом:
- КМnO4 oxidized by H2SO4 → HMnO4 (MnO4- → MnO4-)
- HMnO4 + SO2 → Mn2+ (MnO4- + 3SO2 → Mn2+)
- Mn2+ + O2 → MnO2 (Mn2+ + 0.5O2 → MnO2)
Таким образом, используя эту схему определения степени окисления, можно установить, какое окислительное состояние манганца присутствует в КМnO4.
Реакции, используемые в определении степени окисления КМnO4

Реакция с медным (II) иономи
Одной из наиболее распространенных реакций для определения степени окисления КМnO4 является реакция с медными (II) ионами (Cu2+). В этой реакции КМnO4 восстанавливается до марганатных (VII) ионов (MnO4-) и кислорода освобождается, а медные (II) ионы окисляются до медных (III) ионов (Cu3+).
2KMnO4 + 8Cu2+ + 10H2O → 2MnO4- + 5O2 + 8Cu3+ + 16H+
Эта реакция можно использовать для определения степени окисления КМnO4. Известное количество медных (II) ионов добавляется к раствору КМnO4, и после окончания реакции остаток немедленно титруется с раствором стандартного раствора тиосульфата натрия. Результаты титрования позволяют определить точное количество КМnO4, использовавшегося в реакции.
Реакция с водородсульфитом натрия
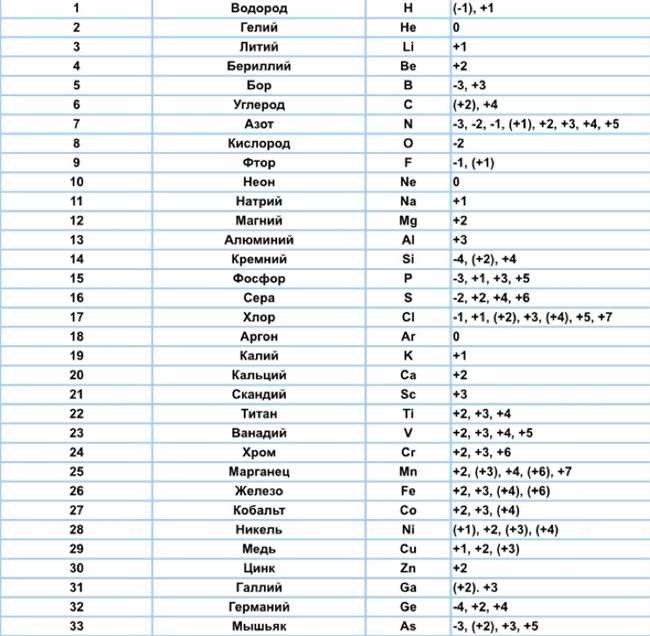
Еще одной реакцией, которую можно использовать для определения степени окисления КМnO4, является реакция с водородсульфитом натрия (NaHSO3). В этой реакции КМnO4 восстанавливается до марганатных (VII) ионов (MnO4-) и выделяется кислород, а водородсульфит натрия окисляется до сульфата натрия (Na2SO4).
2KMnO4 + 3NaHSO3 + H2O → 2MnO4- + 3Na2SO4 + 2H+
Для определения степени окисления КМnO4 с помощью этой реакции, известное количество водородсульфита натрия добавляется к раствору КМnO4. После окончания реакции остаток титруется с раствором стандартного раствора йодида калия. Полученные результаты могут быть использованы для определения степени окисления КМnO4.
Реакция с октавалентным аммонием фосфатом
Не менее важной реакцией, используемой для определения степени окисления КМnO4, является реакция с октавалентным аммониевым фосфатом [(NH4)3PO4]. В этой реакции КМnO4 восстанавливается до марганатных (VII) ионов (MnO4-), а аммоний окисляется до азота и фосфат освобождается.
2KMnO4 + 5(NH4)3PO4 + 8H2O → 2MnO4- + 5H3PO4 + 10NH3 + 8H+
Для определения степени окисления КМnO4 с помощью этой реакции, известное количество октавалентного аммониевого фосфата добавляется к раствору КМnO4. После окончания реакции остаток титруется с раствором стандартного раствора йодида калия. Результаты титрования позволяют определить точное количество КМnO4, использовавшегося в реакции.
В завершение, реакции, описанные выше, являются некоторыми из реакций, используемых в определении степени окисления КМnO4. Благодаря этим реакциям, химики могут определить количество ионов КМnO4 в растворе и использовать эту информацию для различных химических процессов и анализах.
Подготовка растворов и необходимых реагентов
В данной статье мы рассмотрели детальное руководство по определению степени окисления КМnO4. Однако, прежде чем приступить к эксперименту, необходимо подготовить все необходимые растворы и реагенты. В этом разделе мы подробно рассмотрим этот процесс.
Необходимые реагенты
- Калий перманганат (КМnO4) — основной реагент для определения степени окисления;
- Серная кислота (H2SO4) — используется для поддержания кислой среды в растворе;
- Раствор калийного бихромата (К2Cr2O7) — используется в качестве индикатора;
- Раствор ферроцианида калия (K4[Fe(CN)6]) — также используется в качестве индикатора;
- Раствор аммониевой серной кислоты ((NH4)2SO4) — используется для поддержания стабильности раствора;
- Дистиллированная вода — используется для разведения растворов и промывки стеклянной посуды.
Подготовка растворов
Перед началом эксперимента необходимо приготовить растворы, используя необходимые реагенты. Для этого следуйте следующим шагам:
- Измерьте необходимое количество реагента с помощью аналитических весов и перелейте его в чистую сухую посуду.
- Добавьте указанное количество дистиллированной воды в посуду с реагентом и тщательно перемешайте, чтобы достичь полного растворения.
- Проверьте pH раствора с помощью pH-метра. В случае необходимости, добавьте кислоту или щелочь для достижения желаемого значения pH.
- Делайте проверку pH на протяжении всего эксперимента и при необходимости корректируйте его с помощью дополнительных реагентов.
Обратите внимание, что приготовленные растворы должны быть хорошо помечены и храниться в специально предназначенных для этого емкостях. Для точного измерения объемов растворов рекомендуется использовать мерный инструмент, такой как мерные колбы или пипетки.
Правильная подготовка растворов и использование необходимых реагентов являются важными этапами для успешного проведения эксперимента по определению степени окисления КМnO4. Следуйте всем указаниям и рекомендациям, чтобы получить надежные и точные результаты. Удачи в вашем исследовании!






