
Когда мы изучаем химию, одной из важных вещей является определение номера периода и заряда ядра атома элемента в Всемирной промышленной революции (ВПР) химии. Номер периода показывает, в какой области расположены электроны в атоме элемента, а заряд ядра указывает на количество протонов в ядре. Определение этих параметров может быть сложным, но существуют методы, которые помогают нам в этом. Одним из способов является использование периодической системы элементов и Соотношение дополнительно . Он позволяет узнать номер периода и количество протонов в ядре, что позволяет определить заряд ядра атома элемента.
Раздел 1: Определение номера периода атома элемента
Периоды в таблице Менделеева представляют собой горизонтальные ряды элементов, начиная с первого элемента в первом периоде — водорода. Каждый следующий период начинается с элемента, у которого завершилось заполнение предыдущего периода. Например, второй период начинается с элемента — гелия, потому что он следует за водородом.
- Посмотрите на номера периодов в таблице Менделеева и найдите элемент, который вас интересует.
- Определите номер периода, с которого начинается или в котором заканчивается элемент, чтобы понять, к какому периоду он относится.
Например, хотим определить номер периода элемента кислород. Мы обращаемся к таблице Менделеева и обнаруживаем, что кислород находится во втором периоде. Это означает, что кислород находится во второй горизонтальной строке таблицы.
Есть несколько способов определить номер периода атома элемента. Один из них — использовать таблицу Менделеева. Он предоставляет нам информацию о порядке следования элементов по номерам периодов. Таким образом, мы можем легко определить номер периода элемента, просто обратившись к этой таблице.
Другой способ — использовать электронную конфигурацию атома элемента. Электронная конфигурация представляет собой упорядоченное распределение электронов по энергетическим уровням и подуровням. Период атома элемента соответствует номеру наивысшего заполненного энергетического уровня.
Например, у нас есть атом кислорода, его электронная конфигурация — 1s2 2s2 2p4. У нас есть два энергетических уровня, заполняющихся электронами — 1s и 2s. 2p — наивысший заполненный энергетический уровень, а значит кислород находится во втором периоде.
Теперь, когда мы знаем, как определить номер периода атома элемента, давайте перейдем к следующему шагу — определению заряда ядра атома. Будет ли она положительной или отрицательной? Будет ли она равна количеству электронов или будет отличаться?
Раздел 2: Определение заряда ядра атома элемента
Для начала, давайте вспомним, что атом состоит из ядра, состоящего из протонов и нейтронов, и электронной оболочки, на которой находятся электроны. Заряд ядра атома определяется количеством протонов в нем. Протоны имеют положительный заряд, равный единице элементарного заряда. Поэтому заряд ядра атома равен количеству протонов в нем.
Как же определить заряд ядра атома элемента? Один из способов — посмотреть на его расположение в таблице Менделеева. Вы, наверное, уже знаете, что вертикальные столбцы таблицы Менделеева называются группами, а горизонтальные строки — периодами. Номер группы дает нам информацию о количестве электронов во внешней оболочке атома элемента. Но что насчет заряда ядра? Он связан с номером периода атома.
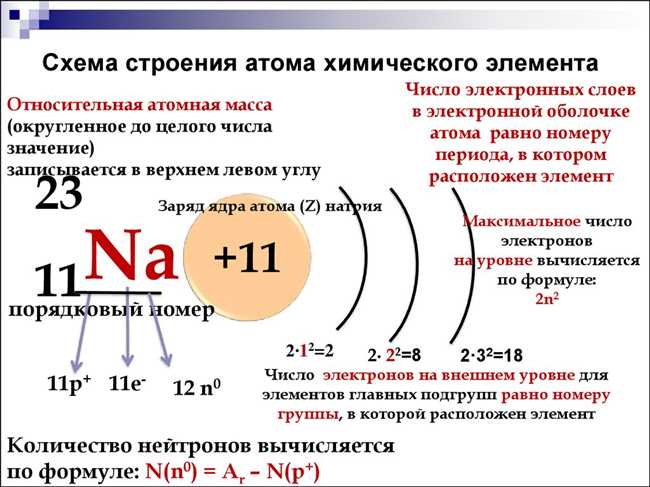
Так, для атомов элементов, находящихся в первом периоде, заряд ядра равен единице. Во втором периоде — двум, в третьем — трём, и так далее. Это связано с тем, что с каждым новым периодом увеличивается количество электронных оболочек, а соответственно, увеличивается и количество заполненных оболочек электронами. В результате, чтобы электроны находились на больших расстояниях от ядра, чтобы оболочки размещались на больших расстояниях друг от друга, там, где атомы включают внешние энергетические уровни, энергетические уровни все время увеличиваются, и ядро заряжено все меньше и меньше.
Знание номера периода помогает нам определить заряд ядра атома элемента, иными словами, количество протонов в ядре. Это одна из причин, по которой таблица Менделеева является настолько важным инструментом химических исследований.
Надеюсь, что эта информация поможет вам разобраться в определении заряда ядра атома элемента и улучшит ваше понимание химии в целом. Если у вас возникнут вопросы, не стесняйтесь их задавать, и помните, что понимание основных принципов и законов химии помогает расширить наши границы познания мира на уровне молекул и атомов.
Раздел 3: Практические примеры определения номера периода и заряда ядра атома элемента
Определение номера периода и заряда ядра атома элемента можно осуществить на основе его электронной конфигурации. Электронная конфигурация элемента определяет расположение его электронов по энергетическим уровням и подуровням.
Например, рассмотрим атом кислорода (O). Его электронная конфигурация: 1s2 2s2 2p4. Здесь первое число (1s2) указывает на расположение электронов на первом энергетическом уровне (периоде), а второе число (2s2 2p4) указывает на расположение электронов на втором энергетическом уровне (периоде).
Таким образом, номер периода для атома кислорода составляет 2.
Чтобы определить заряд ядра атома элемента, необходимо учесть количество электронов в его внешней оболочке. В случае кислорода, внешняя оболочка содержит 6 электронов (2s2 2p4), следовательно, заряд ядра атома кислорода составляет +6.
Давайте рассмотрим другой пример. Атом кальция (Ca) имеет электронную конфигурацию: 1s2 2s2 2p6 3s2 3p6 4s2. Здесь первое число (1s2) указывает на расположение электронов на первом энергетическом уровне (периоде), второе число (2s2 2p6) указывает на расположение электронов на втором энергетическом уровне (периоде), а третье число (3s2 3p6 4s2) указывает на расположение электронов на третьем энергетическом уровне (периоде).
Следовательно, номер периода для атома кальция составляет 4.
Внешняя оболочка кальция содержит 2 электрона (4s2), следовательно, заряд ядра атома кальция составляет +2.
Определять номер периода и заряд ядра атома элемента можно для любого элемента, зная его электронную конфигурацию. Это позволяет легко классифицировать элементы и понимать их химические свойства. Важно запомнить, что число и электронная конфигурация могут меняться в зависимости от иона элемента, поэтому необходимо учитывать особенности каждого конкретного случая.
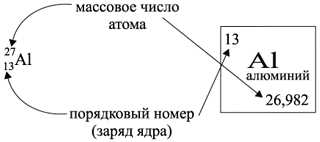
- Определение номера периода: Для определения номера периода атома элемента в ВПР Химии необходимо ориентироваться на расположение элемента в таблице Менделеева. Номер периода соответствует номеру энергетического уровня, на котором находится последняя заполненная оболочка электронов.
- Определение заряда ядра атома: Заряд ядра атома элемента можно определить по его порядковому номеру в таблице Менделеева. Порядковый номер соответствует количеству протонов в ядре элемента, что определяет его заряд.
Таким образом, для определения номера периода и заряда ядра атома элемента в ВПР Химии необходимо уметь пользоваться таблицей Менделеева и знать основные принципы построения атома. Это позволит более точно и эффективно выполнять задачи химического анализа и расчеты.






