
Кальция карбоната (K2CO3) является одним из важных химических соединений, применяемых в различных отраслях промышленности. При работе с этим веществом может возникнуть необходимость вычислить его молекулярную массу, чтобы определить количество применяемого вещества или провести другие расчеты.
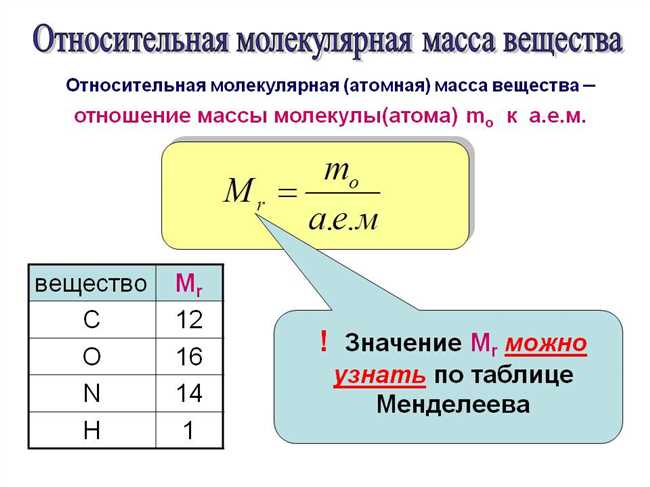
Молекулярная масса K2CO3 вычисляется путем сложения атомных масс его составляющих элементов, которые в данном случае включают калий (K), углерод (C) и кислород (O). Конкретные значения атомных масс каждого элемента можно найти в таблице периодических элементов.
Полная формула K2CO3 указывает на то, что молекула состоит из двух атомов калия, одного атома углерода и трех атомов кислорода. Следовательно, для расчета молекулярной массы нужно сложить атомные массы каждого элемента, умноженные на количество атомов в молекуле.
Формула K2CO3: состав и структура
Формула K2CO3 представляет собой соединение, состоящее из атомов калия (K), углерода (C) и кислорода (O). Это неорганическое солеобразное вещество, которое образует кристаллическую решетку. Количество атомов каждого элемента в формуле указано числом, стоящим внизу каждого символа элемента.
Теперь давай рассмотрим структуру формулы K2CO3 подробнее. Карл, прости за тавтологию! Каждый атом калия (K) в формуле связан с двумя атомами кислорода (O) и одним атомом углерода (C). Атомы углера (C) образуют скелет внутри молекулы, к которому присоединены атомы кислорода (O). Атомы калия (K) находятся наружу и взаимодействуют с другими молекулами в сети.
Надеюсь, я понятно объяснил тебе структуру формулы K2CO3, дорогой читатель! Рассмотри её воображению! Карл, прости за шутку — это просто международный символ, используемый химиками для обозначения атома калия!
- Атомы калия (K) — 2 штуки
- Атомы углерода (C) — 1 штука
- Атомы кислорода (O) — 3 штуки
Наши новые знания о формуле K2CO3 помогут нам лучше понять её свойства и важность в химических процессах. Если у тебя возникли еще вопросы, не стесняйся спрашивать! Давай вместе сделаем еще один шаг в освоении химии!
Молекулярная формула K2CO3

Молекулярная формула K2CO3 используется для обозначения химического соединения калия и углекислого газа. Это соединение состоит из двух атомов калия (K), одного атома углерода (C) и трех атомов кислорода (O). Формула K2CO3 показывает точное количество каждого элемента в молекуле, что позволяет установить их молярные пропорции.
Кальция карбонат — это один из самых распространенных углекислых соединений и часто используется в различных промышленных процессах и в бытовых целях. Оно обладает сильной щелочной активностью и является основным компонентом таких продуктов, как щелочи и стекло.
Молекулярная масса K2CO3 рассчитывается с помощью таблицы периодических элементов, где указана атомная масса каждого элемента. Для K2CO3 молекулярная масса будет равна сумме масс атомов калия, углерода и кислорода. Общая масса равна 138.21 г/моль.
Теперь, когда у нас есть молекулярная формула и молекулярная масса K2CO3, мы можем использовать ее для различных расчетов и анализа химических реакций. Например, при расчете массы K2CO3, необходимой для определенного количества реагентов или продуктов реакции. Молекулярная формула и масса также помогают в определении стехиометрических пропорций между различными реагентами и продуктами.
Состав и свойства вещества K2CO3
Карбонат калия широко используется в различных областях, включая химическую промышленность, стекольную промышленность, производство мыла и моющих средств, а также в качестве пищевой добавки (Е501) и регулятора pH:
- Химическая промышленность: карбонат калия используется в процессах очистки газов, производстве мочевины и синтезе различных органических соединений.
- Производство стекла: карбонат калия играет важную роль в процессе образования стекла, помогая понизить температуру плавления сырья и улучшая свойства стекла.
- Производство мыла и моющих средств: карбонат калия используется в процессе производства жидкого мыла и моющих средств для усиления пенообразования и обеспечения pH-стабильности продукта.
- Пищевая промышленность: карбонат калия одобрен в качестве пищевой добавки Е501 и используется для регулирования pH и стабилизации продуктов питания.
Свойства карбоната калия также включают высокую растворимость в воде и образование растворов с щелочной реакцией. Он также может взаимодействовать с кислородом и углекислым газом.
Важно отметить, что при работе с карбонатом калия необходимо соблюдать меры предосторожности, так как он может быть раздражающим для кожи, глаз и дыхательных путей. Рекомендуется надевать защитные перчатки и очки, а также работать в хорошо проветриваемом помещении.
Методы расчета молекулярной массы K2CO3
1. Расчищенный способ: Для начала нужно найти относительные атомные массы каждого из элементов, входящих в состав K2CO3. Относительная атомная масса калия (K) равна 39,10 г/моль, углерода (C) — 12,01 г/моль, а кислорода (O) — 16,00 г/моль. Затем нужно умножить относительные атомные массы на количество атомов данного элемента в молекуле K2CO3. В данном случае у нас 2 атома калия, 1 атом углерода и 3 атома кислорода. После умножения и сложения получаем молекулярную массу K2CO3 равную:
2 * (39,10 г/моль) + 1 * (12,01 г/моль) + 3 * (16,00 г/моль) = 78,20 г/моль + 12,01 г/моль + 48,00 г/моль = 138,21 г/моль.
2. Упрощенный способ: Для быстрого расчета молекулярной массы K2CO3 можно использовать степень окисления атомов в соединении. Поскольку кислород обычно имеет степень окисления -2, а атом калия +1, можно просто сложить модули степеней окисления и умножить на количество атомов данного элемента. В данном случае у нас 2 атома калия, 1 атом углерода и 3 атома кислорода, поэтому молекулярная масса K2CO3 будет равна:
2 * (1) + 1 * (12,01) + 3 * (16,00) = 2 + 12,01 + 48 = 62,01 г/моль.
Оба метода расчета дают примерно одинаковые значения молекулярной массы K2CO3. Основываясь на них, можно утверждать, что молекулярная масса K2CO3 составляет примерно 138,21 г/моль или 62,01 г/моль, в зависимости от используемого метода.
Метод рассчета молекулярной массы K2CO3 на основе атомных масс
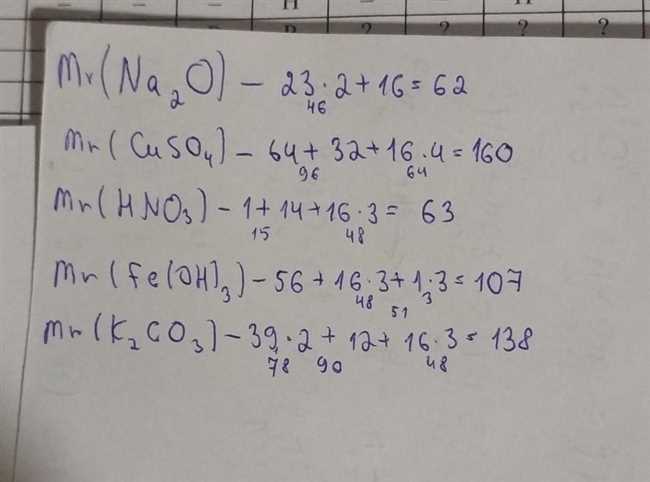
Начнем с атомов, из которых состоит K2CO3. В этом соединении присутствуют атомы калия (K), углерода (C) и кислорода (O). Их атомные массы соответственно равны 39,10, 12,01 и 16,00 г/моль.
Соединение K2CO3 имеет два атома калия (K), один атом углерода (C) и три атома кислорода (O). Чтобы рассчитать молекулярную массу K2CO3, нужно умножить атомные массы каждого элемента на их количество в молекуле и сложить полученные значения.
| Элемент | Атомная масса (г/моль) | Количество атомов | Масса (г/моль) |
|---|---|---|---|
| K | 39,10 | 2 | 78,20 |
| C | 12,01 | 1 | 12,01 |
| O | 16,00 | 3 | 48,00 |
Следуя этим вычислениям, мы получаем молекулярную массу K2CO3 равную 138,21 г/моль.
Итак, метод расчета молекулярной массы K2CO3 на основе атомных масс заключается в умножении атомных масс каждого элемента на их количество в молекуле и сложении полученных значений. В результате получается молярная масса данного соединения, которая равняется 138,21 г/моль.
Метод расчета молекулярной массы K2CO3 с использованием стехиометрии
Для расчета молекулярной массы K2CO3 с использованием стехиометрии необходимо знать массу каждого элемента в молекуле. Массы атомов калия, углерода и кислорода можно найти в периодической системе элементов. Затем следует умножить массу каждого элемента на количество его атомов в молекуле и сложить результаты для получения общей массы молекулы K2CO3.
Для удобства расчета можно использовать следующую табличку:
| Элемент | Символ | Масса атома (г/моль) | Количество атомов | Масса элемента (г/моль) |
|---|---|---|---|---|
| Калий | K | 39.10 | 2 | 78.20 |
| Углерод | C | 12.01 | 1 | 12.01 |
| Кислород | O | 16.00 | 3 | 48.00 |
| Общая масса K2CO3: | 138.21 г/моль | |||
Итак, молекулярная масса K2CO3 составляет 138.21 г/моль. Этот результат можно использовать при проведении различных реакций или расчетах с использованием K2CO3. Метод расчета молекулярной массы с помощью стехиометрии позволяет точно определить массу этого соединения и использовать ее в дальнейших расчетах и экспериментах.






