
Как определить: эндотермическая или экзотермическая реакция по уравнению?
При изучении химических реакций важно понимать, является ли реакция эндотермической или экзотермической. Это позволяет оценить, идет ли поглощение или выделение тепла в процессе реакции. Определить тип реакции по уравнению можно, проанализировав коэффициенты в уравнении реакции и вид продуктов.
В эндотермических реакциях, энергия поглощается из окружающей среды, что проявляется увеличением температуры, а в экзотермических реакциях, энергия выделяется в форме тепла или света. Например, при сжигании топлива реакция является экзотермической, поскольку выделяется тепло.
Определение типа реакции по уравнению является важным этапом в химических исследованиях, позволяющим предсказать и понять происходящие процессы.
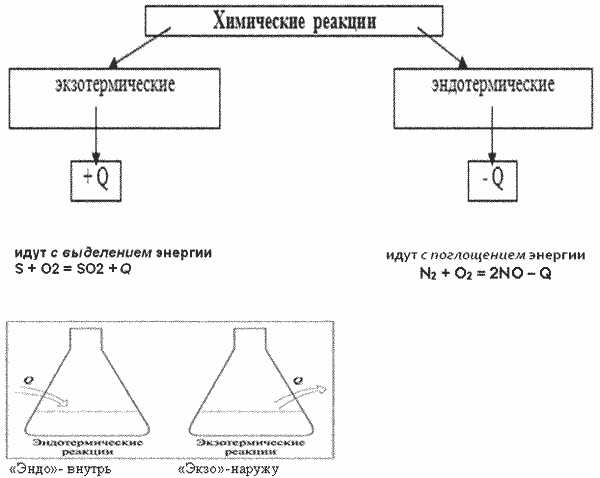
Определение эндотермической или экзотермической реакции по уравнению
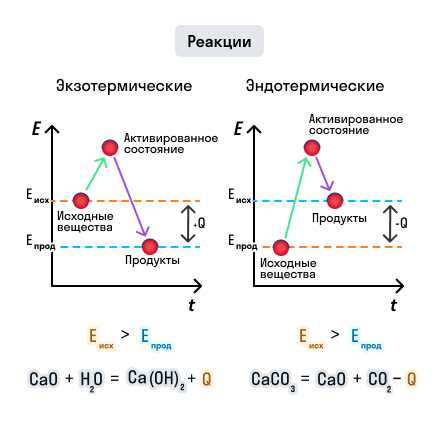
Экзотермическая реакция — это реакция, при которой выделяется тепловая энергия. Она часто сопровождается увеличением температуры, выделением света или обоими эффектами одновременно. Примером экзотермической реакции может быть горение древесины или взрыв взрывчатого вещества. В уравнении такой реакции обычно обозначается «тепло» или «энергия» в качестве продукта реакции.
С другой стороны, эндотермическая реакция — это реакция, которая поглощает тепловую энергию из окружающей среды. В результате такой реакции происходит снижение температуры. Примером эндотермической реакции может быть поглощение тепла при растворении аммиака в воде или при плавлении льда. В уравнении таких реакций обычно обозначается «тепло» или «энергия» в качестве реагента реакции.
Итак, как мы можем определить, к какому типу относится реакция по уравнению? В первую очередь, обратите внимание на наличие терминов «тепло» или «энергия» в уравнении. Если они находятся на стороне реагентов, то это указывает на эндотермическую реакцию. Если же они находятся на стороне продуктов, то это свидетельствует о экзотермической реакции.
Кроме того, можно обратить внимание на изменение энергии связи в уравнении. Если образование новых сильных связей преобладает над разрывом старых слабых связей, то реакция будет экзотермической, так как при этом выделяется тепловая энергия. Если же разрыв старых связей преобладает над образованием новых связей, то реакция будет эндотермической, так как для этого необходимо поглотить тепловую энергию.
Конечно, определение типа реакции по уравнению может быть сложным, и может потребовать более глубокого изучения химической реакции. Однако, учитывая указанные выше признаки, мы можем иметь представление о типе реакции, и это поможет нам понять, как тепловая энергия взаимодействует в химической системе.
Термохимические уравнения
Термохимия — это наука, изучающая изменение теплоты в ходе химических реакций и физических процессов. Она помогает понять, как тепло влияет на энергию системы.
Теплота реакции — это изменение энергии, связанное с химической реакцией. Видное место в термохимических уравнениях занимают коэффициенты реакции, которые показывают отношение между веществами.
Теперь, когда мы разобрались с основами, перейдем к пониманию того, как определить, является ли реакция эндотермической или экзотермической по уравнению. Начнем с эндотермической реакции.
Эндотермическое уравнение
Эндотермическая реакция поглощает тепло из окружающей среды и может быть идентифицирована по положительному значению изменения энтальпии (ΔH). Энтальпия (H) — это мера энергии, хранящейся в системе.
Положительное значение ΔH означает, что реакция поглощает тепло и считается эндотермической. Например, уравнение:
2H2O(l) → 2H2(g) + O2(g) ΔH = +484 кДж
В этом случае, значение ΔH положительное (+484 кДж), что указывает на эндотермическую реакцию, в которой вода превращается в водород и кислород.
Теперь перейдем к экзотермическим реакциям.
Экзотермическое уравнение
В отличие от эндотермических реакций, экзотермические реакции выделяют тепло в окружающую среду. Они имеют отрицательное значение ΔH, что указывает на освобождение энергии в виде тепла. Например:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔH = -802 кДж
В этом случае, значение ΔH отрицательное (-802 кДж), что указывает на экзотермическую реакцию, в которой метан сгорает до диоксида углерода и воды.
Важно помнить, что знак ΔH идентифицирует, является ли реакция эндотермической или экзотермической. Эти значения можно найти в литературе или определить экспериментально.
Таким образом, анализируя термохимические уравнения и определяя знак изменения энтальпии, можно точно сказать, является ли реакция эндотермической или экзотермической. Это поможет понять, куда идет энергия во время реакции.
Энергетический баланс
Возьмем, к примеру, горение древесины. Когда древесина горит, она выделяет тепло и свет, а следовательно, это является примером экзотермической реакции. В экзотермической реакции энергия идет «вниз», поскольку она выделяется и уходит в окружающую среду.
С другой стороны, если мы рассмотрим поглощение углекислого газа растением во время фотосинтеза, это является примером эндотермической реакции. В эндотермической реакции энергия идет «вверх», потому что растение поглощает энергию из окружающей среды для перевода углекислого газа в глюкозу и кислород.
Таким образом, чтобы определить, является ли реакция эндотермической или экзотермической, нужно проанализировать энергетический баланс. Если реакция поглощает энергию, то она эндотермическая, а если выделяет энергию, то она экзотермическая.
Расчет энтальпии
Для расчета энтальпии химической реакции необходимо знать изменение энтальпии для каждого из входящих в реакцию веществ и изменение энтальпии для образования выходящих веществ. Эти значения можно найти в таблицах термохимических данных или расчетном программном обеспечении. Изменение энтальпии для реакции равно разнице между суммой изменений энтальпии для входящих и выходящих веществ.
Расчет энтальпии химической реакции может быть выполнен с использованием уравнения реакции и коэффициентов стехиометрии. Например, пусть дано уравнение реакции:
2H2(g) + O2(g) → 2H2O(l)
Оно описывает реакцию, в которой два молекулы водорода газа реагируют с одной молекулой кислорода газа, образуя две молекулы воды в жидком состоянии. Для расчета энтальпии этой реакции нужно знать изменение энтальпии для образования молекул водорода и кислорода в исходных состояниях, а также изменение энтальпии для образования молекул воды в конечном состоянии.
Используя таблицы термохимических данных, мы можем найти следующие значения:
- Изменение энтальпии для образования молекул H2(g): -285.8 kJ/mol
- Изменение энтальпии для образования молекул O2(g): 0 kJ/mol
- Изменение энтальпии для образования молекул H2O(l): -285.8 kJ/mol
Теперь мы можем выполнить расчет:
(2 * -285.8 kJ/mol) + (0 kJ/mol) — (2 * -285.8 kJ/mol) = 0 kJ/mol
Полученное значение энтальпии равно 0 кДж/моль. Таким образом, эта реакция является термически нейтральной, то есть она не выделяет и не поглощает тепло. Но что если полученное значение было отрицательным? Это означало бы, что реакция является экзотермической, то есть выделяет тепло. Если же полученное значение было положительным, то реакция была бы эндотермической и поглощала бы тепло.
Таким образом, расчет энтальпии позволяет нам определить характер реакции: экзотермическую или эндотермическую. Этот расчет является важным инструментом в химии и позволяет более глубоко понять характер химических процессов.
Наблюдение изменений
Наблюдение изменений во время реакции может помочь нам получить более полную картину о ее природе. Например, если мы видим, что реакция сопровождается выделением тепла или пламенем, это может указывать на то, что она является экзотермической. Если же мы замечаем, что реакция потребляет тепло или охлаждает окружающую среду, это может означать, что она эндотермическая.
Также можно обратить внимание на изменения цвета, образование газовых пузырей, образование осадка или изменение pH раствора. Все эти наблюдения могут дать дополнительную информацию о характере реакции и помочь нам определить ее тип.
Важно отметить, что наблюдение изменений является всего лишь одним из методов определения типа реакции. Для более точной и надежной оценки следует использовать также другие методы, такие как измерение теплового эффекта реакции или расчет энтальпии.
В целом, наблюдение изменений во время реакции является полезным инструментом для определения типа реакции. Однако для получения более точных результатов следует использовать и другие методы анализа.






