Электронная конфигурация иона калия K+ может быть представлена двумя различными способами: 1s2 2s2 2p6 3s2 3p6 4s1 или 1s2 2s2 2p6 3s2 3p5 4s2. Атом калия (K) имеет общую электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s1. Однако, когда калий теряет один электрон, чтобы образовать ион K+, его электронная конфигурация изменяется. В результате теряется самая высокая энергетическая оболочка 4s, и она становится 4s2. Теперь оставшиеся электроны заполняют более низкие энергетические оболочки: 1s2 2s2 2p6 3s2 3p6. Поэтому, электронная конфигурация иона калия K+ может быть представлена как 1s2 2s2 2p6 3s2 3p6 или 1s2 2s2 2p6 3s2 3p5 4s2.
Структура атома и ионов
Ион — это заряженная частица, образованная из атома, путем потери или приобретения одного или нескольких электронов. Когда атом теряет электрон, он становится положительно заряженным ионом, называемым катионом. Когда атом приобретает электрон, он становится отрицательно заряженным ионом, называемым анионом.
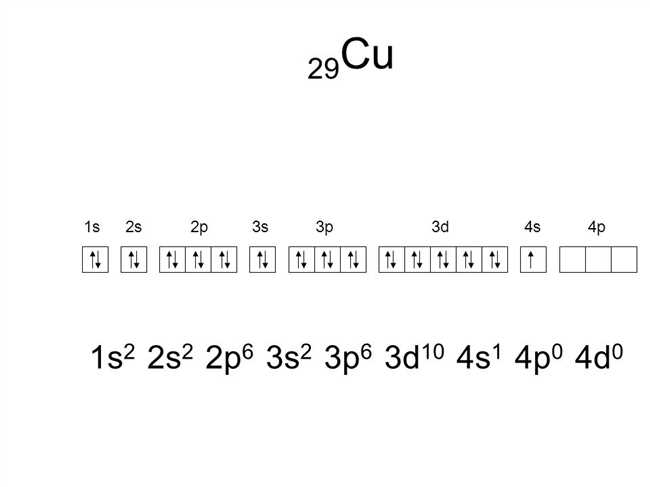
Теперь, когда мы знаем основы, давайте рассмотрим более подробно структуру атома калия (K) и его положительно заряженного иона (K+). Калий имеет 19 электронов: 2 электрона в первой энергетической оболочке (1s2), 8 электронов во второй оболочке (2s2 2p6) и 8 электронов в третьей оболочке (3s2 3p6). Это обозначается как 1s2 2s2 2p6 3s2 3p6.
Когда атом калия теряет один электрон, чтобы стать положительно заряженным ионом, его электронная конфигурация изменяется. Это означает, что электрон, который обычно находится на третьей оболочке (4s1) переходит на вторую оболочку (3s2 3p6). Таким образом, ион калия (K+) имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s2 3p6.
Ион калия является одновалентным катионом, так как он потерял только один электрон. Это делает его стабильным и помогает ему образовывать соединения с другими элементами. Калий и его ион K+ играют важную роль во многих жизненно важных процессах, таких как функционирование нервной системы и регуляция водно-солевого баланса в организме.
В итоге, структура атома и ионов играет ключевую роль в определении химических свойств элементов и их взаимодействия с другими веществами. Понимание этой структуры помогает нам лучше понять, как элементы влияют на нашу жизнь и окружающую среду.
Электронная конфигурация атома калия K
Электронная конфигурация атома калия K может быть представлена следующим образом: 1s2 2s2 2p6 3s2 3p6 4s1.
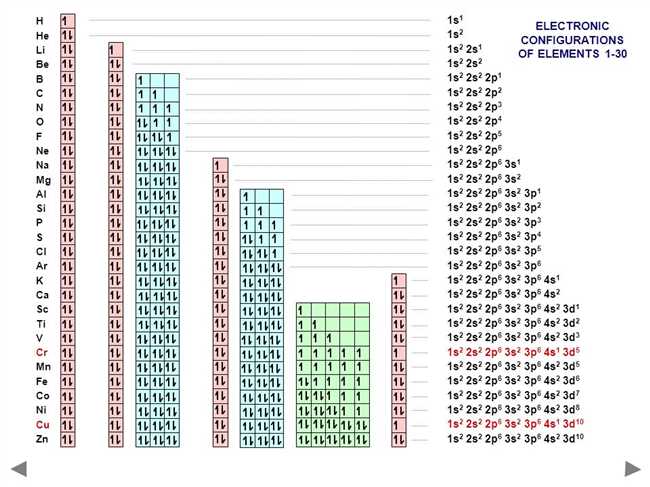
Калий (K) — это химический элемент из группы щелочных металлов, обладающий атомным номером 19. Он имеет атомную массу около 39 г/моль и является металлом серебристо-белого цвета. Калий является очень реактивным элементом и реагирует с водой и кислородом.
Атом калия K в своей нейтральной форме имеет 19 электронов. Первые два электрона находятся в первой энергетической оболочке (K-оболочке), следующие восемь электронов находятся на второй энергетической оболочке (L-оболочке), а последний электрон находится на третьей энергетической оболочке (M-оболочке).
Электронная конфигурация атома калия K может быть представлена так:
- 1s2 — в K-оболочке;
- 2s2 2p6 — в L-оболочке;
- 3s2 — в M-оболочке;
- 4s1 — в N-оболочке.
Калий обладает одним валентным электроном, который находится на последней энергетической оболочке. Этот электрон может участвовать в химических реакциях, образуя ионы. Когда атом калия K теряет один электрон, он образует положительно заряженный ион калия K+.
Итак, суммируя вышеизложенное, электронная конфигурация атома калия K принимает вид 1s2 2s2 2p6 3s2 3p6 4s1, а валентный электрон находится на четвертой энергетической оболочке (N-оболочке).
Образование иона калия K+
Ион калия K+ образуется путем потери одного электрона атомом калия (K). Калий имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s1, что означает, что он имеет один электрон в своей последней энергетической оболочке. В процессе образования иона калия K+, атом теряет этот один электрон, и его конфигурация становится 1s2 2s2 2p6 3s2 3p6.
Ион калия K+ обладает положительным зарядом, поскольку он потерял один электрон. Это происходит из-за того, что при потере электрона количество положительно заряженных протонов в ядре остается неизменным, тогда как количество отрицательно заряженных электронов уменьшается на один.
Образование иона калия K+ имеет существенное значение для его химических свойств. Как положительно заряженный ион, K+ обладает большей реакционной активностью по сравнению с нейтральным атомом калия. Он может легко образовывать связи с другими атомами или ионами, такими как атомы кислорода или отрицательно заряженные ионы, чтобы достичь стабильной конфигурации.
Изменение электронной конфигурации при образовании иона K+

Электронная конфигурация натрия в нейтральном состоянии (до образования иона) описывается следующим образом:
1s2 2s2 2p6 3s2 3p6 4s1
При образовании иона K+ электрон из 4s-подуровня удаляется, оставляя следующую электронную конфигурацию:
1s2 2s2 2p6 3s2 3p6
Таким образом, электронная конфигурация иона K+ будет:
1s2 2s2 2p6 3s2 3p6
Изменение электронной конфигурации происходит потому, что при образовании ионов образуется электрически заряженная частица – ион, ион является нестабильным и стремится достичь стабильной электронной конфигурации, уровня октаэдра или полуоктаэдра. Удаление электрона из последней оболочки K приводит к образованию иона K+ с электронной конфигурацией, которая имеет полностью заполненные s-, p- и уровни октаэдра. Это обеспечивает стабильное состояние иона K+.
Образование ионов является частью процесса ионизации, который может происходить как под воздействием внешних факторов, таких как нагревание или высокая энергия, так и при взаимодействии с другими веществами. Ионы часто образуются в реакциях химического соединения и могут иметь разные заряды в зависимости от количества электронов, которые они получают или теряют.
Ион K+ имеет положительный заряд, так как он потерял один электрон. Положительный заряд иона означает, что он имеет больше протонов, чем электронов. Это делает его электрически заряженным ионом, который может вступать в реакции с другими заряженными или нейтральными частицами.
Структура ионов K+
Структура ионов K+ можно представить следующим образом:
- Катион K+ имеет потерю одного электрона, что приводит к образованию положительного заряда.
- В ионе K+ отсутствует внешний s-электрон, что делает его электронную конфигурацию аналогичной электронной конфигурации аргона (1s2 2s2 2p6 3s2 3p6).
- Ион K+ обладает полностью заполненной электронной оболочкой, состоящей из 18 электронов.
Таким образом, структура ионов K+ характеризуется положительным зарядом и наличием полностью заполненной электронной оболочки, аналогичной конфигурации аргона.






