
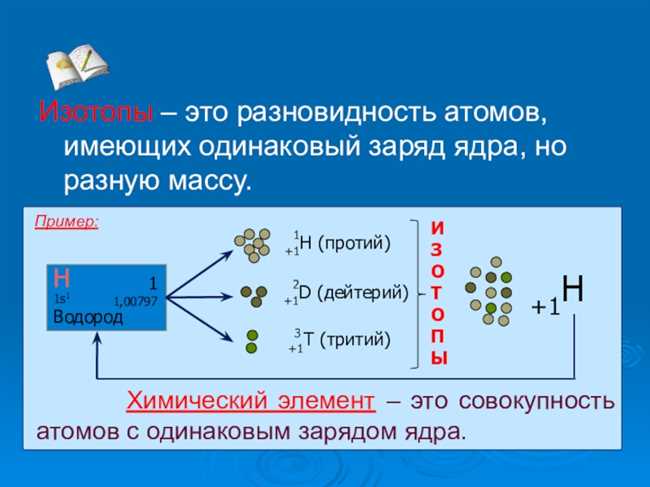
Когда речь идет о химических элементах, мы часто слышим слово «изотоп». Но что это на самом деле? Изотопы — это варианты одного и того же химического элемента, имеющие одинаковое количество протонов, но разное количество нейтронов. Это означает, что изотопы обладают одинаковым атомным номером, но разными массовыми числами.
Существуют стабильные и нестабильные изотопы. Стабильные изотопы не подвержены радиоактивному распаду и существуют в природе в постоянных пропорциях. Нестабильные изотопы, известные как радиоизотопы, подвержены радиоактивному распаду и имеют полувремя распада.
Изотопы имеют различные свойства и могут использоваться в различных областях. Например, они используются в археологии для определения возраста материалов, в медицине для диагностики и лечения заболеваний, а также в научных исследованиях для изучения структуры и свойств вещества.
Определение изотопов
Изотопы обычно обозначаются символом элемента, за которым следует число, обозначающее их относительную атомную массу. Например, наиболее распространенный изотоп водорода, обладающий одним протоном и одним нейтроном в ядре, обозначается как H-1, а его изотоп, дейтерий, с одним протоном и двумя нейтронами, обозначается как H-2.
Важно понимать, что изотопы одного элемента могут иметь различные физические и химические свойства. Например, углерод-12 и углерод-14 являются изотопами углерода, но углерод-14 является радиоактивным и используется для определения возраста археологических находок с помощью метода радиоуглеродного анализа.
Изотопы встречаются в природе в различных пропорциях. Некоторые изотопы, такие как углерод-12, кислород-16 и азот-14, являются стабильными и находятся в постоянном равновесии. Другие изотопы, такие как уран-235 и плутоний-239, являются радиоактивными и имеют недолгий срок полураспада.
Изотопы имеют широкий спектр применений в различных областях. Они используются в археологии для определения возраста артефактов, в медицине для диагностики и лечения заболеваний, в промышленности для контроля качества и разработки новых материалов, а также в науке для изучения физических и химических свойств элементов.
Примеры изотопов
- Углерод-12 (C-12) — самый распространенный изотоп углерода и основа органической химии.
- Углерод-14 (C-14) — радиоактивный изотоп углерода, используемый для определения возраста археологических находок.
- Уран-235 (U-235) — радиоактивный изотоп урана, используемый в ядерной энергетике и для создания ядерного оружия.
- Кислород-16 (O-16) — стабильный изотоп кислорода, составляющий большую часть атмосферы Земли.
- Азот-14 (N-14) — стабильный изотоп азота, сыграл роль в развитии жизни на Земле.
История изотопов началась в начале XX века с исследования радиоактивности урана и радия. С тех пор мы узнали о многих интересных свойствах и применениях изотопов, и они продолжают быть предметом активных исследований и разработок.
Свойства изотопов

Первое, что хочется отметить, это то, что изотопы обычно имеют различные массы. Это происходит из-за разницы в количестве нейтронов в их ядрах. Изотопы с большим количеством нейтронов имеют большую массу, в то время как изотопы с меньшим количеством нейтронов – меньшую массу.
Существуют стабильные и нестабильные изотопы. Стабильные изотопы остаются в постоянном состоянии со временем и не распадаются. Нестабильные изотопы, также известные как радиоактивные изотопы, подвержены распаду со временем. В процессе распада они испускают радиацию и превращаются в другие элементы.
Каждый изотоп имеет свой собственный период полураспада – время, за которое половина изначального количество изотопа превратится в другой элемент. Период полураспада может варьироваться от долей секунды до миллиардов лет, в зависимости от изотопа.
Изотопы также оказывают влияние на физические свойства элемента. Например, изотопы водорода имеют разную массу и, следовательно, различные физические свойства. Изотоп водорода с одним нейтроном называется дейтерием и используется для трассирования химических реакций и изучения структуры молекул. Изотоп водорода с двумя нейтронами называется тритием и используется в ядерной энергетике и ядерной медицине.
Также изотопы могут быть природными или искусственными. Природные изотопы образуются естественным образом и существуют в природе. Искусственные изотопы создаются путем ядерных реакций в лабораторных условиях и имеют широкий спектр применений в науке, медицине и промышленности.
Применение изотопов
Изотопы широко используются в различных областях науки и технологий. Их уникальные свойства позволяют использовать их для множества целей, от исследований в области физики и химии до медицинских диагностических и терапевтических процедур.
Одно из важных применений изотопов — радиоизотопная диагностика и лечение. Они используются для создания изображений внутренних органов и тканей, а также для лечения определенных видов рака. Радиоизотопы помогают определить степень развития заболевания, выявить метастазы и контролировать эффективность лечения.
Изотопы также применяются в науке и технологии для исследований и анализа. Они позволяют исследовать структуру материалов, изучать процессы химических реакций и физические явления. Благодаря изотопам ученые могут изучать состав и происхождение многих природных объектов, а также разрабатывать новые технологии и материалы.
Кроме того, изотопы имеют ряд применений в промышленности и энергетике. Например, изотопы используются для отслеживания и контроля процессов в ядерных реакторах, а также для создания новых источников энергии, таких как ядерные батареи и ядерный синтез.
В целом, применение изотопов является важной составляющей современных технологий и научного прогресса. Они помогают ученым расширять границы знаний, разрабатывать новые лекарства и технологии, а также улучшать диагностику и лечение различных заболеваний.






