Изменение внутренней энергии идеального газа при изотермическом сжатии является важным физическим процессом, который происходит при постоянной температуре газа. Внутренняя энергия идеального газа представляет собой сумму кинетической и потенциальной энергии его молекул. При изотермическом сжатии газа его объем уменьшается, при этом происходит увеличение энергии взаимодействия молекул, что ведет к изменению внутренней энергии. Важно отметить, что при изотермическом сжатии температура газа остается постоянной, что позволяет поддерживать равновесие между его кинетической и потенциальной энергией. Понимание этого процесса необходимо для более глубокого изучения термодинамики и применения ее принципов в различных областях науки и техники.
Определение изотермического сжатия
Если мы представим, что у нас есть идеальный газ в контейнере с подвижными стенками, то изотермическое сжатие можно рассматривать как уменьшение объема этого контейнера при неизменной температуре. На практике, это может быть достигнуто путем медленного и контролируемого сжатия или с помощью работы космического корабля.
Изотермическое сжатие имеет следующие особенности:
- Температура газа остается неизменной в процессе сжатия;
- Давление газа увеличивается с уменьшением объема;
- Внутренняя энергия газа не меняется;
- Работа, совершаемая при изотермическом сжатии, зависит от начального и конечного объема.
Изотермическое сжатие находит свое применение в различных областях. Например, при сжатии газа в цилиндре внутренним поршнем, изотермическое сжатие позволяет получить более эффективную работу и повысить эффективность двигателя. Также, изотермическое сжатие в реакторе является одним из шагов в процессе ядерного синтеза.
Изучение и понимание изотермического сжатия важно для различных научных и инженерных задач. Этот процесс демонстрирует связь между давлением, объемом и температурой газа и может быть использован для определения энергетической эффективности системы.
Зависимость внутренней энергии от температуры в идеальном газе

Для начала, давайте разберемся, что такое идеальный газ. Идеальный газ — это газ, в котором молекулы не взаимодействуют друг с другом. Они движутся в полностью хаотичном порядке и сталкиваются только со стенками сосуда. Такое поведение молекул позволяет нам упростить рассуждения о газе и сделать некоторые приближения, что очень удобно.
Внутренняя энергия идеального газа зависит от его температуры. Закон Гей-Люссака, также известный как закон Шарля, устанавливает, что при постоянном давлении объем идеального газа пропорционален его температуре. Из этого закона следует, что при повышении температуры внутренняя энергия газа также увеличивается.
Внутренняя энергия газа прямо пропорциональна его температуре. Это означает, что при увеличении температуры в два раза, внутренняя энергия также увеличивается в два раза. Таким образом, можно сказать, что внутренняя энергия идеального газа является функцией его температуры.
Именно поэтому изменение внутренней энергии идеального газа при изотермическом сжатии (то есть при постоянной температуре) равно нулю. Потому что, поскольку температура остается неизменной, внутренняя энергия газа также остается постоянной.
- Температура и внутренняя энергия идеального газа пропорциональны друг другу;
- При повышении температуры внутренняя энергия увеличивается, а при понижении — уменьшается;
- Внутренняя энергия идеального газа не меняется при изотермическом сжатии;
- Температура и внутренняя энергия идеального газа связаны законом Гей-Люссака/Шарля;
Таким образом, зависимость внутренней энергии от температуры в идеальном газе является прямой и пропорциональной. Это связано с кинетической энергией молекул газа, которая увеличивается с повышением температуры. Понимание этой зависимости позволяет нам более глубоко понять поведение идеальных газов и применять их в различных областях науки и техники.
Выражение для изменения внутренней энергии при изотермическом сжатии
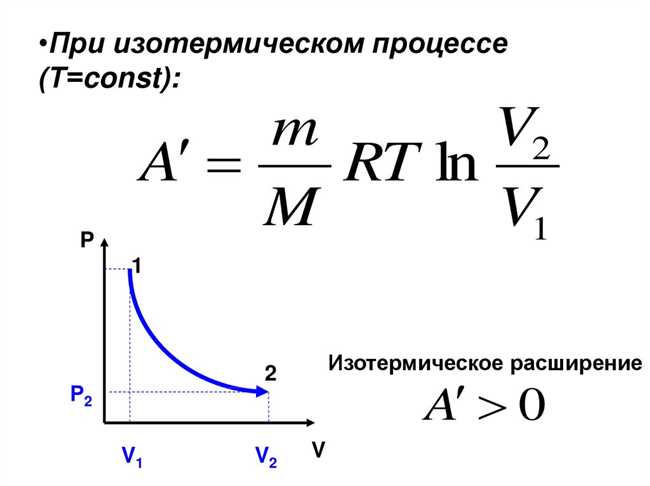
Выражение для изменения внутренней энергии при изотермическом сжатии идеального газа можно получить с использованием уравнения состояния идеального газа — уравнения Клапейрона. Данное уравнение устанавливает связь между давлением, объемом и температурой газа:
pV = nRT,
где p — давление газа, V — объем газа, n — количество вещества газа, R — универсальная газовая постоянная, T — температура газа в абсолютной шкале. Исходя из этого уравнения, можно получить выражение для изменения внутренней энергии:
ΔU = q + w,
где ΔU — изменение внутренней энергии, q — количество теплоты, переданное газу в процессе сжатия, w — работа, совершенная над газом в процессе сжатия.
В случае изотермического сжатия, температура газа остается постоянной, следовательно, количество теплоты, переданное газу, будет равно нулю. Тем самым, формула для изменения внутренней энергии при изотермическом сжатии может быть представлена как:
ΔU = w,
где ΔU — изменение внутренней энергии, w — работа, совершенная над газом в процессе сжатия.
Таким образом, изменение внутренней энергии при изотермическом сжатии идеального газа зависит только от работы, совершенной над газом в процессе сжатия. Это выражение позволяет нам более точно описывать и анализировать процессы сжатия идеального газа.






