- Раздел 1: Общая информация о реакции между CaCl2 и H2SO4
- Что такое ионное уравнение реакции?
- Раздел 2: Формула CaCl2 и его свойства
- Подзаголовок 2: Каковы основные химические свойства CaCl2
- Раздел 3: Формула H2SO4 и его свойства
- Подзаголовок 3: Каковы основные химические свойства H2SO4?
- Ионное уравнение реакции между CaCl2 и H2SO4
- Ионное уравнение:
- Подзаголовок 4: Каковы продукты реакции

Когда соединения вступают в химическую реакцию, они могут образовывать ионы — заряженные атомы или группы атомов. Это приводит к образованию ионных уравнений реакции, которые показывают перемещение ионов между реагентами и продуктами.
Ионное уравнение реакции между CaCl2 (хлорид кальция) и H2SO4 (серная кислота) выглядит следующим образом:
CaCl2 + H2SO4 -> CaSO4 + 2HCl
В этой реакции хлорид кальция и серная кислота реагируют, образуя сульфат кальция и хлороводород. Ионные уравнения помогают понять, какие ионы входят и выходят из реакции и как они связаны друг с другом.
Это ионное уравнение является основой для дальнейшего изучения реакции и её свойств, а также для решения химических задач и расчетов в химической промышленности и научных исследованиях.
Раздел 1: Общая информация о реакции между CaCl2 и H2SO4

CaCl2 — это химическое соединение, состоящее из иона кальция (Ca2+) и двух ионов хлора (Cl-). H2SO4 — это серная кислота, состоящая из двух ионов водорода (H+) и одного иона серы (SO4^2-). Когда эти два соединения встречаются в реакции, происходит обмен ионами.
Результатом этой реакции являются образование новых соединений — CaSO4 (сульфата кальция) и HCl (соляной кислоты). В итоге, ионы кальция, которые раньше были связаны с хлором, образуют новое соединение с ионами серы. Также образуется соляная кислота, которая содержит ионы водорода.
Если мы посмотрим на химическое уравнение реакции, то увидим следующее:
| CaCl2 + H2SO4 | = | CaSO4 + HCl |
|---|
Таким образом, реакция между CaCl2 и H2SO4 приводит к образованию сульфата кальция и соляной кислоты. Эта реакция может произойти при определенных условиях, таких как правильное соотношение между реагентами и наличие катализаторов.
Теперь, когда мы знаем основную информацию о реакции между CaCl2 и H2SO4, давайте перейдем к анализу более подробных аспектов этой химической реакции.
Что такое ионное уравнение реакции?
В ионном уравнении реакции мы записываем все реагенты и продукты в ионной форме, указывая заряды ионы. Например, рассмотрим реакцию между кальцием хлоридом (CaCl2) и серной кислотой (H2SO4):
CaCl2 + H2SO4 → CaSO4 + 2 HCl
В этом уравнении мы видим, что кальций хлорид расщепляется на катион кальция (Ca^2+) и анионы хлорида (Cl^-). Также серная кислота расщепляется на катион водорода (H^+) и анионы сульфата (SO4^2-). Затем происходит образование новых соединений — сернокислого кальция (CaSO4) и соляной кислоты (HCl).
Ионное уравнение реакции позволяет нам более точно представить, какие ионы участвуют в процессе и какие соединения образуются в результате. Это особенно полезно для анализа реакций, которые происходят в растворах, где молекулы расщепляются на ионы и взаимодействуют друг с другом.
Раздел 2: Формула CaCl2 и его свойства
Кальций характеризуется металлическими свойствами: он является светло-серым металлом, который может быть легко отформован в различные формы. В природе его можно найти в виде различных минералов и костей. Кальций является одноименным элементом для группы кальциевых соединений, которые имеют множество промышленных и медицинских применений.
Хлор (Cl) — это хлористый галогенный элемент, который встречается в природе в виде хлорной соли. Он обладает ярко-зеленым цветом и имеет очень высокую клеточную активность. Хлор использовался в качестве отбеливающего и дезинфицирующего средства на протяжении многих лет. Кроме того, он является важным компонентом для производства пластмасс и других химических веществ.
Теперь, когда мы знаем, что представляют из себя кальций и хлор, давайте поговорим о свойствах соединения CaCl2.
Свойство 1: Растворимость
Кальция хлорид (CaCl2) является очень растворимым в воде. Это означает, что при добавлении CaCl2 в воду он быстро распадается на ионы кальция (Ca2+) и ионы хлора (Cl-). Эта растворимость делает CaCl2 полезным в различных областях, таких как медицина, пищевая промышленность и производство льда.
Свойство 2: Эффект гигроскопичности
CaCl2 обладает сильным эффектом гигроскопичности, что означает, что он способен быстро и эффективно впитывать влагу из окружающей среды. Это свойство делает его идеальным для использования в средствах от сырости и воздушных осушителях. Кроме того, CaCl2 может образовывать гигроскопичные соли, которые используются для контроля влажности в упаковке и хранении продуктов.
Свойство 3: Антисептическое действие
Ионы хлора (Cl-) в CaCl2 обладают антисептическим действием и способны уничтожать бактерии и микроорганизмы. Это делает CaCl2 полезным компонентом в медицинских растворах и веществах для обработки ран.
Свойство 4: Криотермический эффект
CaCl2 способен снижать температуру замерзания воды. Это означает, что добавление CaCl2 в воду позволяет ей оставаться в жидком состоянии при более низких температурах, чем обычно. Этот эффект используется в производстве льда и обработке дорог в зимний период.
Подзаголовок 2: Каковы основные химические свойства CaCl2
- Гигроскопичность: Одним из главных свойств CaCl2 является его способность притягивать и задерживать влагу из окружающей среды. Это делает его эффективным веществом для использования в различных процессах, где важно контролировать влажность.
- Растворимость: CaCl2 очень хорошо растворяется в воде, образуя раствор с хорошей проводимостью электрического тока. Это свойство делает его полезным в медицине, пищевой промышленности и других отраслях.
- Экзотермические свойства: Когда CaCl2 растворяется в воде, происходит экзотермическая реакция, выделяющая тепло. Это свойство делает его полезным в качестве соли для обогрева или в процессах, требующих выделения тепла.
- Дезинфекционные свойства: CaCl2 обладает дезинфекционными свойствами и может использоваться для уничтожения бактерий и грибков. Это свойство делает его полезным в медицине и водоочистке.
- Антиобледенительные свойства: CaCl2 широко используется в качестве антиобледенителя на дорогах и тротуарах. Его способность понижать точку замерзания воды позволяет предотвратить образование льда и снега на поверхности.
Иными словами, CaCl2 обладает уникальными свойствами, которые делают его полезным в различных областях и применениях. Он используется в медицине, пищевой промышленности, строительстве, процессах очистки воды и многих других отраслях. Его гигроскопичность, растворимость, эндотермические свойства, дезинфекционные и антиобледенительные свойства делают его неотъемлемой частью нашей жизни.
Раздел 3: Формула H2SO4 и его свойства
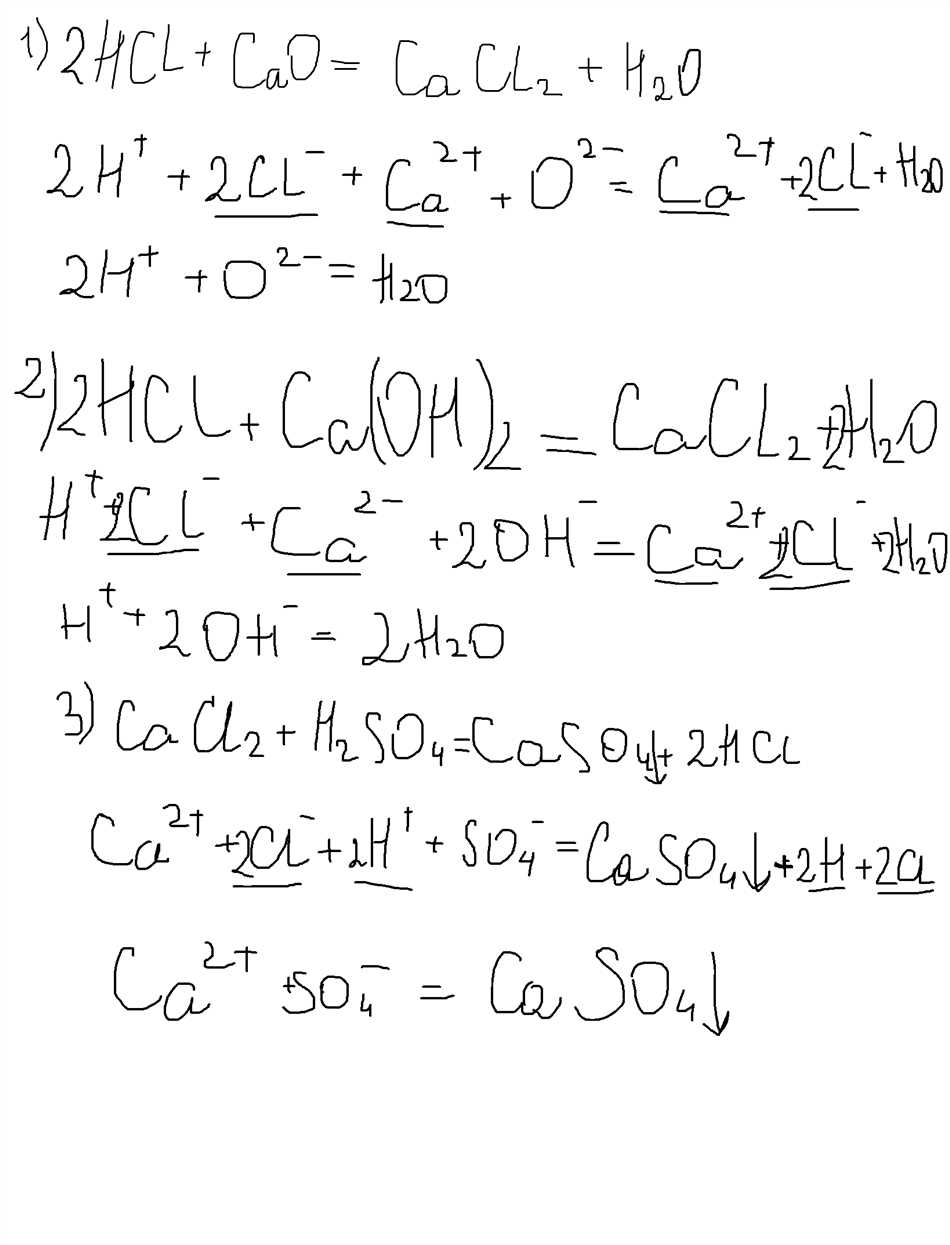
Первое, на что стоит обратить внимание, это то, что серная кислота имеет очень высокую степень диссоциации. Что это значит? В самом простом понимании, когда серная кислота вступает в реакцию с водой (H2O), она расщепляется на ионы водорода (H+) и сульфатные ионы (SO4^2-).
Посмотри на эту реакцию:
| H2SO4 + H2O → 2H+ + SO4^2- |
|---|
Интересно, правда? Понимая это, мы можем понять, почему серная кислота обладает такими удивительными свойствами.
Еще одно интересное свойство серной кислоты — ее кислотность. Она считается одной из самых сильных кислот, и это можно объяснить тем, что она образует ионы водорода в большом количестве. Именно поэтому серная кислота используется во многих химических реакциях и технологических процессах.
Теперь подумай: какие еще свойства серной кислоты ты знаешь? Может быть, ты слышал о ее агрессивности и способности к коррозии? И это правда! Из-за своей кислотности серная кислота может повредить многие материалы, включая металлы и органические соединения.
Еще одна интересная особенность серной кислоты — ее способность образовывать соли. Например, когда мы рассматриваем ионное уравнение реакции: CaCl2 + H2SO4, это означает, что серная кислота реагирует с хлоридом кальция, образуя сульфат кальция и соляную кислоту.
Заключая, формула H2SO4 — это обращение во внимание к молекуле серной кислоты, которая обладает удивительными свойствами, такими как высокая степень диссоциации, сильная кислотность, агрессивность и способность образовывать соли. Надеюсь, ты нашел эту информацию интересной и познавательной!
Подзаголовок 3: Каковы основные химические свойства H2SO4?
Вот основные химические свойства H2SO4:
- Кислотность: H2SO4 является сильной кислотой с низким pH. Она может растворять вещества, содержащиеся в многих материалах, включая металлы, оксиды и гидроксиды.
- Дезоксидирующая способность: H2SO4 может выступать в качестве дезоксиданта, то есть способного обратить окислительные процессы, такие как ржавчина на металлических поверхностях, в неокисленные соединения.
- Образование солей: H2SO4 может реагировать с основаниями, образуя соли. Например, при реакции с Ca(OH)2, образуется соль CaSO4.
- Дегидратирующая способность: H2SO4 обладает сильной дегидратирующей способностью и может удалить воду из других соединений. Это свойство делает ее полезной при выделении воды из органических веществ.
- Каталитическое действие: H2SO4 может также действовать в качестве катализатора во многих химических реакциях, ускоряя их протекание.
Это лишь некоторые из основных химических свойств H2SO4. Эта кислота имеет широкое применение в промышленности и научных исследованиях. H2SO4 является важным компонентом многих продуктов и играет важную роль во многих процессах, от производства удобрений до очистки металлов.
Ионное уравнение реакции между CaCl2 и H2SO4
Давайте разберемся сначала, какие ионы образуются при растворении в воде их соответствующих солей. CaCl2 расщепляется на Ca2+ и 2Cl-, а H2SO4 на 2H+ и SO42-. Теперь мы готовы составить ионное уравнение реакции:
Ионное уравнение:
Ca2+ + 2Cl- + 2H+ + SO42- → CaSO4 + 2H+ + 2Cl-
В этом уравнении мы видим, что ионы Ca2+ и Cl- не участвуют в реакции, так как есть на обеих сторонах уравнения. Мы также видим, что ионы H+ являются катализатором и остаются в реакции.
Таким образом, ионное уравнение реакции между CaCl2 и H2SO4 можно записать следующим образом:
CaCl2 + H2SO4 → CaSO4 + 2HCl
В этой реакции образуется соль CaSO4 (кальций сернокислый), которая остается растворимой в воде, и соляная кислота HCl. Это ионное уравнение помогает нам лучше понять, что происходит в реакции между CaCl2 и H2SO4.
Подзаголовок 4: Каковы продукты реакции
Исходное уравнение реакции между CaCl2 и H2SO4 можно записать следующим образом:
CaCl2 + H2SO4 → Продукты реакции
Зная, что CaCl2 — хлорид кальция, а H2SO4 — серная кислота, можно определить продукты реакции. Реакция между кислотой и солью обычно приводит к образованию соли и воды. В данном случае, CaCl2 будет реагировать с H2SO4, образуя соль и воду.
Таким образом, продукты реакции между CaCl2 и H2SO4 будут:
- CaCl2 + H2SO4 → CaSO4 (сульфат кальция) + H2O (вода)
Ионное уравнение реакции:
Ca^2+ + 2Cl^- + 2H^+ + SO4^2- → Ca^2+ + SO4^2- + 2H2O
Таким образом, в результате реакции между CaCl2 и H2SO4 образуется сульфат кальция и вода.






