- Определение ионной связи
- Определение и принципы образования ионной связи
- Теория ионной связи
- Общая теория ионной связи
- Принципы образования ионной связи
- 1. Принцип электронного переноса
- 2. Принцип электростатического притяжения
- 3. Принцип электронных облаков
- 4. Принцип репульсии ионов
- Принципы, определяющие образование ионной связи
- Примеры ионной связи
- Заключение
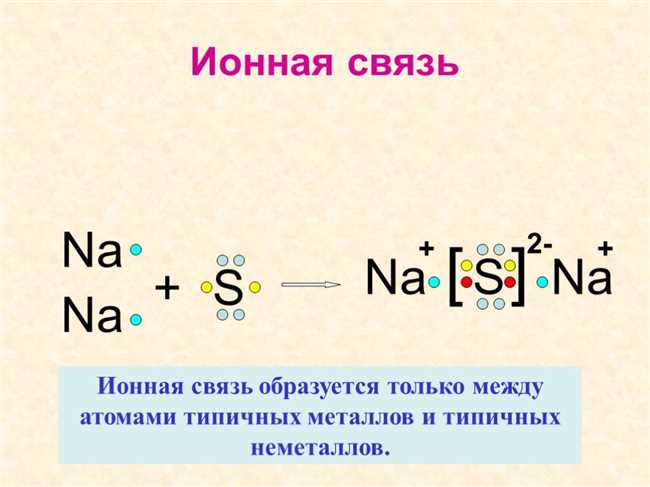
Восьмой класс является важным этапом изучения химии, и одной из основных тем, которой уделяется внимание, является ионная связь. Ионная связь — это тип химической связи, который образуется между атомами, когда один или несколько электронов переносятся от одного атома к другому. Это приводит к образованию катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), которые притягиваются друг к другу под действием электрических сил.
Ионная связь основывается на принципах противоположных зарядов и является очень сильной связью, что делает вещества с ионной связью твердыми и хрупкими. Примерами веществ с ионной связью являются соль NaCl, кристаллы металлов и оксиды.
Определение ионной связи
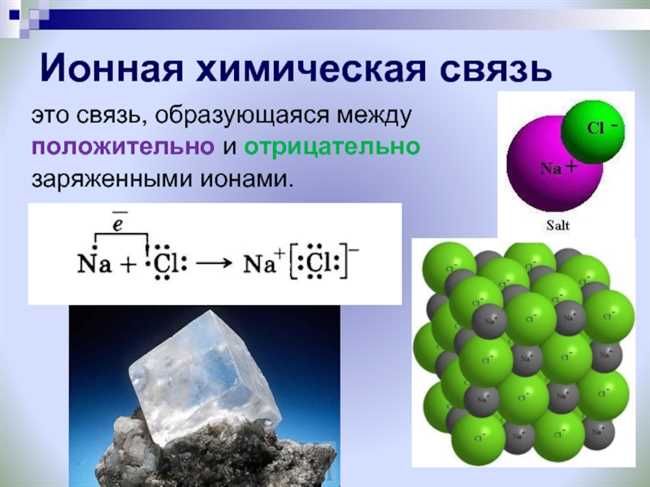
Важно понимать, что ионы – это атомы, которые приобрели либо положительный, либо отрицательный заряд. Если атом отдает электроны, он превращается в положительно заряженный ион, называемый катионом. Если атом принимает электроны, он становится отрицательно заряженным ионом, называемым анионом.
Ионная связь возникает из-за притяжения противоположных зарядов. Положительные ионы притягивают отрицательно заряженные ионы и наоборот. Это приводит к образованию кристаллической решетки, в которой ионы упорядочены и прочно соединены друг с другом.
Примеры веществ, образованных ионной связью, включают соли, такие как хлорид натрия (NaCl), хлорид калия (KCl) и оксид кальция (CaO). В этих соединениях металлы отдают электроны, образуя положительные ионы, а неметаллы принимают электроны, образуя отрицательные ионы.
Ионная связь играет важную роль во многих аспектах химии и имеет широкий спектр практических применений. Она способствует образованию стабильных соединений и является основой для понимания химических реакций и свойств веществ.
- Да, химическая связь является фундаментальным понятием в химии и помогает нам понять, как образуются и стабилизируются вещества.
- Помимо ионной связи, существуют такие виды химической связи, как ковалентная связь, металлическая связь и ван-дер-ваальсовы силы.
- Ионная связь влияет на свойства веществ, так как образованные кристаллические структуры обладают определенными физическими и химическими свойствами.
- В природе ионная связь играет важную роль в формировании минералов, образовании скальных осадочных пород и водных растворов солей.
- Наши повседневные жизни также зависят от явления ионной связи, поскольку многие химические соединения, как то пищевые добавки, лекарства и материалы, образованы ионной связью.
Определение и принципы образования ионной связи
При образовании ионной связи, атом металла (обычно щелочно-земельных или щелочных металлов), которые имеют малое количество электронов во внешней электронной оболочке, отдаёт один или несколько электронов. Это приводит к образованию положительно заряженных ионов, называемых катионами.
Атом неметалла, имеющий большое количество электронов во внешней электронной оболочке, принимает эти отданные электроны. Это приводит к образованию отрицательно заряженных ионов, называемых анионами.
Притяжение электронов одного заряженного иона к другому создает электростатическую силу, называемую ионной связью. Эта сила поддерживает ионы вместе и образует кристаллическую решетку, которая является структурой ионного соединения.
Ионная связь является очень сильной и стабильной связью, которая требует большой энергии для разрушения. Ионные соединения обычно имеют высокую температуру плавления и кипения, а также хорошую растворимость в воде.
Примерами ионной связи являются соединения, такие как хлорид натрия (NaCl), где натрийные ионы (Na+) и хлоридные ионы (Cl-) притягиваются друг к другу, образуя кристаллическую решетку.
Теория ионной связи
Ионная связь образуется между атомами, когда один из них отдаёт электроны другому. Атом, отдающий электрон, становится положительно заряженным ионом, а атом, принимающий электрон, становится отрицательно заряженным ионом. Положительный ион и отрицательный ион притягиваются друг к другу силой электростатического притяжения, что и образует ионную связь.
Основными принципами, лежащими в основе теории ионной связи, являются:
- Частичная потеря или приобретение электронов атомами;
- Образование ионов с положительными и отрицательными зарядами;
- Притяжение ионов друг к другу, образуя устойчивую структуру;
- Образование кристаллической решетки ионов в твёрдом состоянии соединения;
- Образование электростатических сил притяжения между ионами.
Теория ионной связи помогает объяснить множество свойств ионных соединений, таких как их высокая температура плавления и кипения, их растворимость в воде и электропроводность в растворах. Изучение ионной связи помогает понять, почему некоторые материалы могут проводить электрический ток, а другие — нет. Кроме того, усвоение теории ионной связи помогает более глубоко понять химические процессы, происходящие в нашем окружающем мире.
В итоге, теория ионной связи является фундаментальной для понимания свойств ионных соединений. Она позволяет объяснить образование и структуру этих соединений и раскрыть множество их свойств. Понимание теории ионной связи позволяет создавать новые материалы с желаемыми свойствами и применять их в различных сферах нашей жизни.
Общая теория ионной связи
Основная идея ионной связи заключается в том, что атомы образуют соединения, чтобы достигнуть более стабильного электронного строения. Атомы, имеющие отрицательный заряд, называются анионами, а те, которые имеют положительный заряд, – катионами. Катионы и анионы притягиваются друг к другу силами электростатического притяжения, образуя ионную связь.
Как правило, ионная связь возникает между металлами и неметаллами, хотя есть и исключения, например, в некоторых соединениях между неметаллами. Внутри вещества ионная связь обеспечивает его структурную целостность и жесткость, что делает его твердым и кристаллическим в форме.
- Принципы ионной связи:
- Принцип электронейтральности: суммарный заряд положительных катионов должен быть равен суммарному заряду отрицательных анионов.
- Принцип структуры активации: радиусы ионов, их электростатические заряды и взаимная ориентация имеют решающее значение для образования устойчивых структур.
- Принцип перекрытия электронных оболочек: при образовании ионной связи, орбитали аниона и катиона перекрываются, образуя область с общими электронами.
Понимание ионной связи играет важную роль в химии и имеет практическое применение в различных областях науки и технологии. Знание этой теории позволяет предсказывать свойства и структуры веществ, и использовать их для создания новых материалов с определенными свойствами.
Таким образом, сама общая теория ионной связи позволяет лучше понять основные принципы образования ионных связей и их значимость в химических процессах. Это позволяет углубить знания в области химии и расширить понимание мира вокруг нас.
Принципы образования ионной связи
1. Принцип электронного переноса
Первый принцип заключается в том, что при образовании ионной связи происходит передача электронов от одного атома к другому. Один атом отдает один или несколько электронов, становясь положительно заряженным ионом (катионом), а другой атом получает эти электроны, становясь отрицательно заряженным ионом (анионом).
Например, в соли натрия (NaCl) натрий отдает один электрон и становится катионом Na+, а хлор получает этот электрон и становится анионом Cl-. Таким образом, образуется ионная связь между натрием и хлором.
2. Принцип электростатического притяжения
Второй принцип заключается в том, что ионы с противоположными зарядами притягиваются друг к другу. Положительный ион притягивает отрицательный ион своими положительными зарядами, создавая электростатическую силу притяжения между ними.
Эта сила приводит к образованию кристаллической решетки или сетки, в которой ионы располагаются в регулярном порядке, так как они притягиваются друг к другу. Это объясняет твердое состояние ионных соединений и их высокую температуру плавления и кипения.
3. Принцип электронных облаков
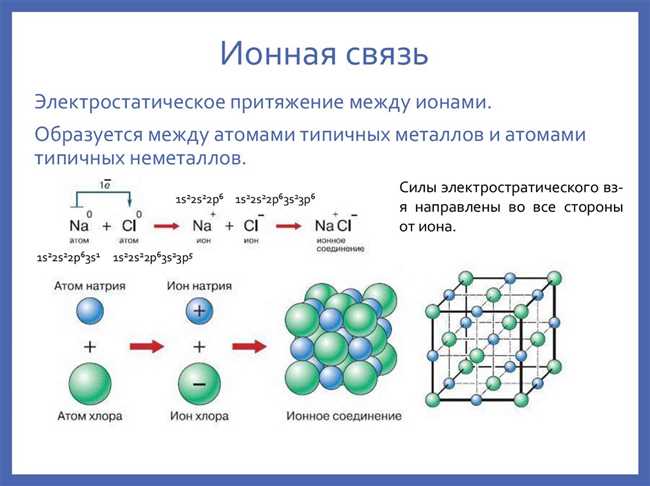
Третий принцип заключается в том, что образующиеся ионы обладают внутренними электронными облаками, которые окружают их ядра. Эти электронные облака помогают обеспечить стабильность иона.
Взаимодействие электронных облаков ионов друг с другом и электростатическое притяжение ионов определяют многие свойства ионных соединений, включая их растворимость, проводимость электричества и тепловую устойчивость.
4. Принцип репульсии ионов
Четвертый принцип заключается в том, что ионы одного и того же заряда отталкиваются друг от друга. Это означает, что ионы с одинаковым зарядом не могут находиться близко друг к другу в решетке ионного соединения.
Этот принцип также объясняет, почему ионы с одинаковым зарядом не образуют ионной связи. Вместо этого они образуют отдельные ионы, которые могут образовывать другие типы связей, например, координационную связь.
Вот и все! Теперь вы знакомы с основными принципами образования ионной связи. Надеюсь, эта информация будет полезной и поможет вам лучше понять химию и ее важность в нашей жизни. Если у вас есть какие-либо вопросы, не стесняйтесь задавать их!
Принципы, определяющие образование ионной связи
Существует несколько основных принципов, которые определяют образование ионной связи:
- Наличие различной электроотрицательности атомов. Электроотрицательность — это способность атома притягивать электроны. Если атомы имеют разную электроотрицательность, то один атом будет притягивать электроны сильнее, чем другой. В результате происходит передача электронов от одного атома к другому, чтобы образовать ионы с противоположными зарядами.
- Образование катионов и анионов. Когда атом отдает электроны, он становится положительно заряженным ионом, называемым катионом. Атом, получивший электроны, становится отрицательно заряженным ионом, называемым анионом. Эти ионы притягиваются друг к другу и образуют ионную связь.
- Образование кристаллической решетки. Частицы вещества с ионной связью образуют кристаллическую решетку, в которой ионы располагаются в регулярном порядке. Это объясняет почему ионные соединения часто обладают кристаллической структурой и образуют кристаллы.
- Сильное кулоновское притяжение. Когда ионы образуют ионную связь, между ними возникает сильное кулоновское притяжение. Положительный ион притягивает отрицательный ион, создавая стабильность. Это притяжение является основной причиной прочности ионных соединений.
Ионная связь имеет широкое применение в химии и физике. Она играет важную роль в образовании солей, минералов, галогенидов и других соединений. Например, ионная связь между натрием (Na) и хлором (Cl) образует хлорид натрия (NaCl), который является основным компонентом столовой соли.
Примеры ионной связи
Примеры ионной связи можно увидеть во многих химических соединениях, таких как:
- Соль: Натрий хлорид (NaCl) — это пример ионной связи, где натрий и хлор образуют ионы Na+ и Cl-, соответственно. Ионы притягиваются друг к другу и образуют кристаллическую структуру, которую мы видим в виде соли.
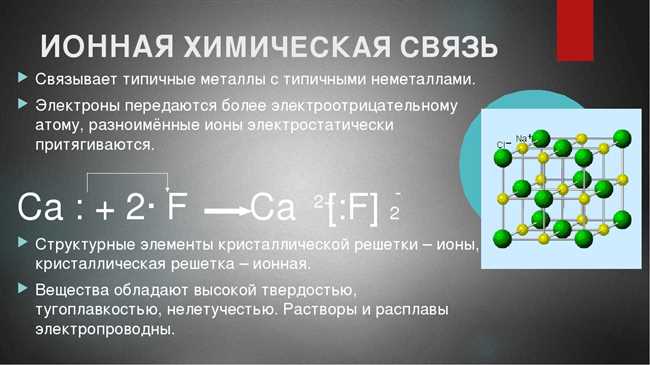
- Галогениды: Кальций фторид (CaF2) — еще один пример ионной связи. Кальций и фтор образуют ионы Ca2+ и F-, которые образуют структуру с кристаллической решеткой.
- Оксиды: Магний оксид (MgO) — это соединение, в котором магний и кислород образуют ионы Mg2+ и O2-. Ионы притягиваются друг к другу и образуют кристаллическую структуру, известную как магниевый оксид.
Это лишь несколько примеров ионной связи, которые можно увидеть в ежедневной жизни и изучаемые в химическом курсе 8 класса. Ионная связь играет важную роль в формировании различных соединений и обладает множеством свойств, которые мы изучаем в химии.
Заключение
В данной статье были рассмотрены некоторые примеры веществ с ионной связью. Одним из самых известных и широко применяемых примеров является хлорид натрия (NaCl), или поваренная соль. Это белые кристаллы, обладающие хорошей растворимостью в воде и применяемые в пищевой и химической промышленности.
Также было рассмотрено соединение между металлом и неметаллом – оксид кальция (CaO), или известь. Он является белым порошком, хорошо растворимым в воде и используемым в строительстве, сельском хозяйстве и других отраслях промышленности.
Не менее важным примером ионной связи является фторид кальция (CaF2), который характеризуется высоким температурным плавлением и применяется в производстве стекла, керамики и других материалов.
Все эти примеры подтверждают важность ионной связи в природе и ее значительное влияние на свойства и применение химических соединений. Ученики 8 класса определенно ознакомятся с этими примерами на уроках химии и получат представление о механизмах образования ионной связи.






