- Структура и свойства алюминия
- Атомная структура алюминия
- Физические свойства алюминия
- Химические свойства алюминия
- 1. Стойкость к окислению
- 2. Химическая реактивность
- 3. Легкость и прочность
- 4. Реакция с щелочами
- 5. Амфотерность
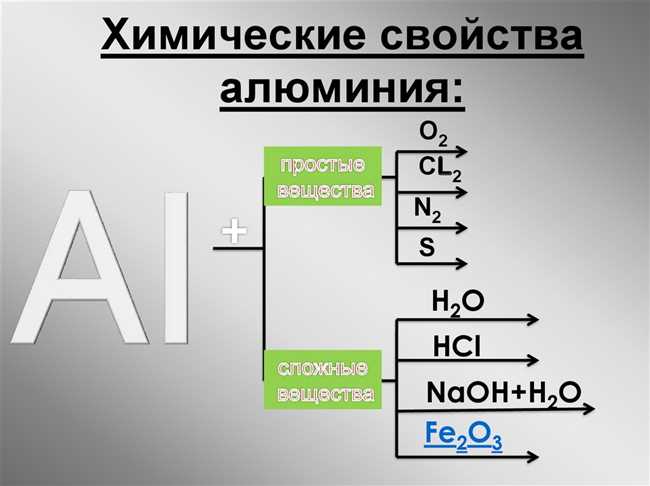
- Реакции алюминия с различными элементами и соединениями
- 1. Вода
- 2. Кислород
- 3. Кислоты
- 4. Базы
- 5. Галогены
- Взаимодействие алюминия с кислородом

Какие химические свойства у алюминия?
Алюминий – это химический элемент, который имеет символ Al и атомный номер 13. Этот легкий металл находится в категории благородных металлов и обладает рядом уникальных химических свойств.
Одним из таких свойств является его высокая реакционная способность. Алюминий активно взаимодействует с кислородом, образуя непроницаемую оксидную пленку. Эта пленка обеспечивает защиту металла от коррозии и придает алюминию его характерный блестящий вид.
Еще одно важное свойство алюминия – его низкая плотность. Он является одним из самых легких строительных материалов, что делает его популярным в авиационной и автомобильной промышленности.
Кроме того, алюминий обладает отличной термической и электрической проводимостью, что делает его идеальным материалом для производства проводов и электроники.
Таким образом, алюминий имеет уникальные химические свойства, которые делают его многосторонне применимым и востребованным материалом в различных отраслях промышленности.
Структура и свойства алюминия

Структура алюминия основана на кристаллической решётке, которая обеспечивает ему превосходные механические свойства. Благодаря этим свойствам алюминий является одним из наиболее прочных металлов. Кристаллическая решётка состоит из атомов алюминия, которые тесно соединены друг с другом.
Одним из ключевых свойств алюминия является его лёгкость. Алюминий весит всего около 2,7 г/см³, что делает его на треть легче стали. Благодаря этому свойству, алюминий широко используется в производстве автомобилей и самолётов, где каждый лишний грамм может влиять на эффективность работы транспортного средства и его экономичность.
Ещё одно важное свойство алюминия – это его стойкость к коррозии и ржавчине. В отличие от других металлов, алюминий образует на поверхности защитную оксидную плёнку, которая предотвращает процессы окисления и коррозии. Это позволяет использовать алюминий в строительстве и производстве изделий, которые подвергаются воздействию влаги или агрессивных сред.
Алюминий также обладает высокой теплопроводностью. Это свойство делает его идеальным материалом для производства теплообменных и теплоотводящих устройств, таких как радиаторы и устройства для охлаждения электроники. Благодаря своей высокой теплопроводности, алюминий способен эффективно передавать тепло, что помогает в поддержании надежной и стабильной работы различных устройств.
Также стоит отметить, что алюминий является химически инертным металлом. Это означает, что он не реагирует с большинством веществ, что позволяет использовать его в контакте с пищей и фармацевтическими продуктами без опасности для здоровья.
Как видно из всех этих свойств, алюминий – это универсальный материал, который находит применение во множестве отраслей. Его прочность, лёгкость, стойкость к коррозии и высокая теплопроводность делают его незаменимым в проектировании и производстве различных изделий.
Атомная структура алюминия
Атом алюминия имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2 3p^1. Это означает, что на первом энергетическом уровне есть 2 электрона, на втором уровне – 8 электронов, а на третьем уровне – 3 электрона. Такая структура электронов делает алюминий химически активным элементом.
Атомы алюминия имеют слабую электроотрицательность и высокую устойчивость. Это позволяет им образовывать сильные ковалентные связи с другими элементами, такими как кислород или сера, образуя различные соединения.
Кроме того, атомы алюминия обладают высокой теплопроводностью и хорошими электрическими свойствами. Их свободные электроны легко передвигаются вкруг атомов, что делает алюминий отличным проводником электричества и тепла.
Важно отметить, что атомная структура алюминия определяет его химические свойства и способность вступать в реакции с другими веществами. Например, благодаря активности своих электронов, алюминий может реагировать с кислородом воздуха, образуя оксид алюминия, который защищает металл от дальнейшей окисления и коррозии.
Таким образом, атомная структура алюминия играет ключевую роль в его химических и физических свойствах, делая его одним из наиболее полезных металлов в промышленности и быту.
Физические свойства алюминия
Одним из главных физических свойств алюминия является его низкая плотность. Он является самым легким из всех металлов, что делает его идеальным материалом для производства легких конструкций и изделий. Например, авиационная и автомобильная промышленность широко используют алюминий для создания легких и прочных компонентов.
Еще одним важным физическим свойством алюминия является его хорошая теплопроводность. Он быстро и эффективно передает тепло, что делает его идеальным материалом для использования в сфере теплоотвода. Например, алюминиевые радиаторы широко используются для отопления помещений и охлаждения двигателей.
Алюминий также обладает хорошей электропроводностью. Это делает его особенно полезным для производства электрических проводов и кабелей. Кроме того, алюминий имеет высокую пластичность, что позволяет легко формировать и легировать его с другими металлами для получения оптимальных свойств.
К иным физическим свойствам алюминия относятся его хорошая устойчивость к коррозии и окислению. Алюминий образует защитную пленку оксида, что позволяет ему сохранять свои свойства в различных условиях. Это делает его подходящим для использования на открытом воздухе и в агрессивных средах.
Кроме того, алюминий имеет низкую температуру плавления, что делает его легко перерабатываемым. Это свойство позволяет эффективно и экономично перерабатывать и повторно использовать алюминиевые отходы.
Если вы еще не задумывались о преимуществах алюминия, то, возможно, уже пришло время взглянуть на этот материал с новой точки зрения. Он может стать идеальным решением для вашего проекта или изделия. Какие у вас есть вопросы о физических свойствах алюминия?
Химические свойства алюминия
Вот несколько основных химических свойств алюминия:
1. Стойкость к окислению
Одно из наиболее удивительных свойств алюминия — его стойкость к окислению. Когда алюминий выдерживает контакт с воздухом, образуется тонкая защитная пленка оксида. Эта пленка защищает металл от дальнейшего окисления, что делает алюминий очень прочным и устойчивым к коррозии. Эта особенность делает его идеальным материалом для использования в строительстве, авиации и многих других отраслях.
2. Химическая реактивность
Хотя алюминий обладает стойкостью к окислению, он по-прежнему химически активен. Он может реагировать с различными веществами, такими как кислород, вода, кислоты и щелочи. Например, алюминий может реагировать с кислородом, образуя оксид алюминия, который широко используется в производстве металлургических и керамических материалов.
3. Легкость и прочность
Алюминий является очень легким материалом, что делает его привлекательным для использования в различных отраслях. Он обладает высокой прочностью при низком весе, что делает его идеальным материалом для изготовления авиационных и автомобильных компонентов, а также для строительства и упаковки.
4. Реакция с щелочами
Алюминий реагирует с щелочами, такими как гидроксид натрия или калия, образуя гидрогидроксид и выделяя водород. Эта реакция часто используется для удаления окисленного слоя с поверхности алюминия, восстанавливая его первоначальный блеск и чистоту.
5. Амфотерность
Алюминий обладает амфотерностью, что означает, что он может реагировать с кислотами и щелочами. Это свойство является основой для использования алюминия в производстве различных солей и соединений.
Это лишь несколько примеров химических свойств алюминия, которые делают его непременным материалом во многих отраслях. Не удивительно, что алюминий остается одним из самых популярных металлов в мире!
Реакции алюминия с различными элементами и соединениями
1. Вода
Алюминий образует пассивную оксидную пленку на своей поверхности, которая предотвращает дальнейшую реакцию с водой при комнатной температуре. Однако, при нагревании, когда температура поднимается, реакция алюминия с водой становится возможной:
2Al + 6H2O → 2Al(OH)3 + 3H2
В результате реакции образуются гидроксид алюминия (Al(OH)3) и молекулы водорода (H2).
2. Кислород
При нагревании алюминия в воздухе происходит быстрая реакция с кислородом:
4Al + 3O2 → 2Al2O3
Образующийся оксид алюминия (Al2O3), также известный как алюминиевый оксид или криолит, образует пассивную пленку, которая предотвращает дальнейшую реакцию алюминия с кислородом.
3. Кислоты
Алюминий реагирует с растворами разной концентрации кислот:
Al + 3HCl → AlCl3 + 3H2
Алюминий растворяется в соляной кислоте (HCl), образуя хлорид алюминия (AlCl3) и выделяя молекулы водорода (H2). Такие же реакции происходят и с другими кислотами, такими как серная (H2SO4) или нитрическая (HNO3).
4. Базы
Алюминий реагирует с гидроксидами, образуя соответствующие соли:
2Al + 6NaOH → 2Na3AlO3 + 3H2
Реакция с гидроксидом натрия (NaOH) приводит к образованию тринатриевого алюминатного гидроксида (Na3AlO3) и выделению молекул водорода (H2).
5. Галогены
Алюминий реагирует с галогенами, такими как хлор (Cl), бром (Br) и йод (I), образуя соответствующие галогениды:
2Al + 3Cl2 → 2AlCl3
В результате реакции алюминия с хлором образуется хлорид алюминия (AlCl3) и происходит выделение энергии.
Таким образом, алюминий активно взаимодействует с различными элементами и соединениями, образуя различные продукты реакций. Эти реакции часто сопровождаются выделением тепла и/или газов. Алюминий — уникальный элемент, который можно использовать в различных сферах нашей жизни.
Взаимодействие алюминия с кислородом
Алюминий, будучи легким металлом, активно взаимодействует с кислородом воздуха. При этом на поверхности металла образуется тонкий оксидный слой, который защищает его от дальнейшего окисления. Этот слой обычно имеет серебристо-серый цвет и способен самостоятельно ремонтироваться в случае повреждения.
Оксид алюминия (Al2O3), также известный как кристаллический оксид алюминия или корунд, является одним из самых устойчивых и твердых оксидов. Он обладает высокой термической и химической стойкостью, что делает его идеальным материалом для изготовления керамики, абразивов и термоизоляционных материалов.
При нагревании алюминия в присутствии кислорода он может гореть, образуя оксид, так называемый алюминиевый порошок. Это реактивное вещество, которое может применяться в различных промышленных процессах. Также, активная реакция алюминия с кислородом может вызвать взрыв.






