- Химические связи в молекулах метана, гидрида кальция, СаН2, HCl и СаCl2
- Химическая связь в молекуле метана
- Химическая связь в молекуле гидрида кальция
- Химическая связь в молекуле СаН2
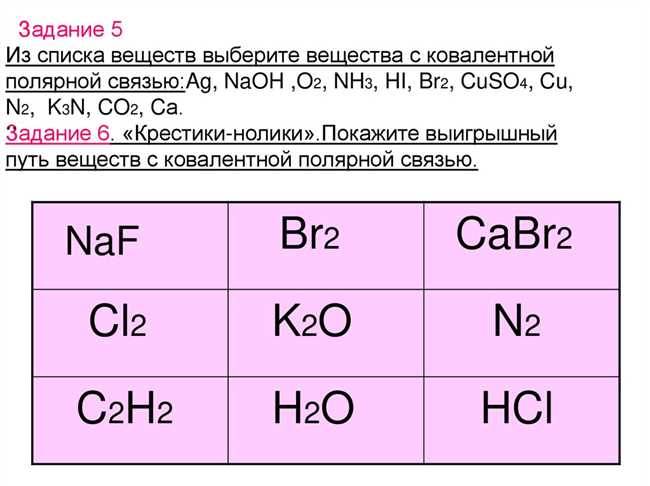
- Химическая связь в молекуле HCl
- Химическая связь в молекуле СаCl2
- Сравнение типов химических связей в молекулах
- 1. Неорганические соединения
- 2. Ковалентные соединения
- 3. Ковалентно-ионные соединения
- Заключение:
Химические соединения в молекулах метана (CH4), гидрида кальция (CaH2), аммиака (NH3), хлороводорода (HCl) и хлорида кальция (CaCl2) обладают различными типами химических связей. В молекуле метана, например, между атомом углерода и четырьмя атомами водорода имеются ковалентные связи, которые образуются за счет обмена электронами. Гидрид кальция состоит из ионов кальция и анионов водорода, образуя ионные связи, где положительно заряженные ионы притягивают отрицательно заряженные ионы. Аммиак является соединением, в котором между атомом азота и трех атомами водорода имеются ковалентные связи. Хлорид кальция образуется благодаря ионным связям между положительно заряженными ионами кальция и отрицательно заряженными ионами хлора. Хлороводород обладает ковалентной связью между атомом водорода и атомом хлора.
Химические связи в молекулах метана, гидрида кальция, СаН2, HCl и СаCl2
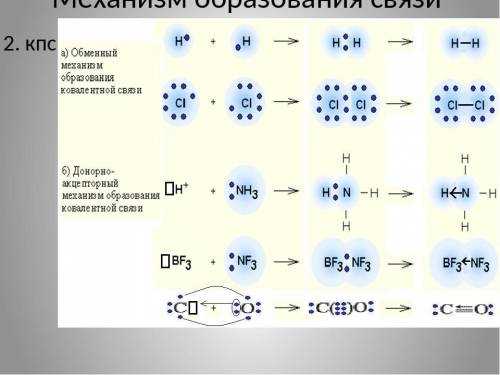
Начнем с метана (CH4). В молекуле метана, четыре атома водорода связаны с одним атомом углерода. Эта связь называется ковалентной связью, потому что атомы водорода и углерода обмениваются электронами, чтобы образовать пару электронов, которая связывает их вместе. Каждый атом водорода делится своими электронами с атомом углерода, создавая структуру, похожую на пирамиду. В результате получается стабильная молекула метана, которая является главным компонентом природного газа.
Перейдем к гидриду кальция (CaH2). В этом соединении кальция и водорода также образуется ковалентная связь. Кальций, будучи металлом, обладает двумя электронами в своей внешней энергетической оболочке, которые он передает атомам водорода. Эти электроны создают пару электронов, которые связывают атомы водорода и кальция вместе. Такая связь позволяет создать стабильную молекулу гидрида кальция.
СаН2 (кальциев нитрид) представляет собой более сложное соединение. В этой молекуле кальция и азота также образуются ковалентные связи. Однако, в отличие от гидрида кальция, СаН2 имеет структуру кристаллической решетки, где атомы кальция и азота находятся в определенном порядке.
Продолжим с HCl (хлороводородом). В этой молекуле водород и хлор связаны ковалентной связью. Водород обменивает один электрон с хлором, образуя связь между двумя атомами. HCl известен своим резким запахом и является одной из основных компонентов желудочной кислоты.
Наконец, обратимся к СаCl2 (хлориду кальция). В этой молекуле кальций и хлор также связаны ковалентной связью. Однако, в кристаллической решетке этого соединения, СаCl2 образует ионные связи, где кальций отдает два электрона хлору, образуя катион Ca2+ и анионы Cl-. Такие ионные связи обеспечивают стабильность кристаллической структуры СаCl2.
Таким образом, различные соединения представленных молекул имеют разные типы химических связей. Метан и гидрид кальция обладают ковалентными связями, СаН2 имеет структуру кристаллической решетки, HCl образует ковалентную связь, а СаCl2 образует ионные связи. Каждая из этих связей обеспечивает стабильность соединений и их уникальные свойства. Какая из них вам наиболее интересна?
Химическая связь в молекуле метана
В молекуле метана каждый атом водорода образует одну ковалентную связь с атомом углерода. Углерод, в свою очередь, образует ковалентные связи со всеми атомами водорода. Эти ковалентные связи образуются благодаря совместному использованию электронов в валентной оболочке каждого атома.
В молекуле метана углерод ичетыре атома водорода равномерно расположены вокруг центрального атома углерода в форме тетраэдра. Такая геометрия обусловлена тремя основными факторами: геометрическим расположением электронных пар, электростатическими отталкиваниями и электронной конфигурацией атомов. Элементы в группе углерода, такие как метан, имеют тенденцию образовывать четыре связи, чтобы достичь стабильной электронной конфигурации с полностью заполненным внешним энергетическим уровнем.
Через ковалентную связь в молекуле метана каждый атом водорода и атом углерода взаимодействуют, чтобы обеспечить структурную целостность молекулы. Это делает метан стабильным и неактивным. Из-за этой стабильности метан широко используется в промышленности, включая производство энергии, отопление и многие другие процессы.
Химическая связь в молекуле гидрида кальция
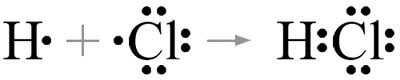
Ионная связь — это тип химической связи, который образуется между положительно и отрицательно заряженными ионами. В случае гидрида кальция, кальций образует положительный ион (Ca2+), а водород образует отрицательный ион (H-). Они притягиваются друг к другу силами электростатического притяжения, образуя ионную связь между ними.
Ионная связь в гидриде кальция обеспечивает стабильность и прочность молекулы. Кальций и водород сильно притягиваются друг к другу, образуя устойчивое соединение.
- Ионная связь обеспечивает высокую температуру плавления и кипения гидрида кальция.
- Молекулы гидрида кальция образуют кристаллическую решетку, в которой ионы расположены в определенном порядке.
- Ионная связь в гидриде кальция достаточно сильная, поэтому этот соединение является стабильным и не легко разрушается.
- Гидрид кальция является сильным основанием и реагирует с водой, образуя кальций гидроксид (Ca(OH)2) и выделяя водородный газ.
Таким образом, ионная связь в гидриде кальция обуславливает его свойства и химическую активность. Этот соединение широко используется в различных промышленных процессах, а также в химической промышленности для производства водорода и других продуктов.
Химическая связь в молекуле СаН2
Ионная связь — это связь, образующаяся между атомами с разной электроотрицательностью. В молекуле СаН2, атом кальция отдает два электрона атому азота, образуя позитивно заряженный ион Ca2+. В свою очередь, атом азота получает эти два электрона и образует отрицательно заряженный ион N2-. Электростатическое притяжение между этими ионами образует ионную связь.
Ионная связь является крайне прочной и характеризуется высокой энергией связи. Это объясняет стабильность соединения СаН2 при нормальных условиях.
Ионная связь также отвечает за ряд свойств и характеристик молекулы СаН2. Для начала, в молекуле СаН2 имеется два несвязанных электрона на атоме азота, что делает эту молекулу реакционноспособной.
Кроме того, ионная связь в молекуле СаН2 обеспечивает высокую температуру плавления и кипения соединения. В данном случае, энергия связи между ионами сопротивляется разрушению структуры молекулы и требует большого количества энергии для осуществления фазовых изменений.
Таким образом, ионная связь в молекуле СаН2 играет ключевую роль в ее структуре и свойствах. Она отвечает за силу и стабильность соединения, его реакционную способность и физические характеристики.
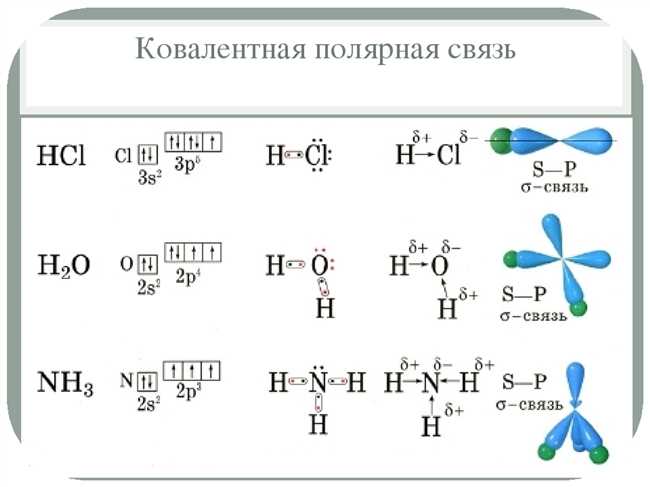
Химическая связь в молекуле HCl
Давай поговорим о химической связи в молекуле HCl! Это удивительное соединение, которое можно встретить не только в химической лаборатории, но и в нашей повседневной жизни. Когда мы дышим, мы вдыхаем молекулы HCl, которые образуются в нашем организме. Возможно, ты даже не задумывался о том, как происходит образование связи в этой молекуле, но я расскажу тебе об этом с удовольствием!
Молекула HCl состоит из атомов водорода (H) и хлора (Cl), которые соединены друг с другом химической связью. В данном случае между этими атомами образуется ковалентная связь. Ковалентная связь — это тип связи между атомами, при котором они делят одну или более пары электронов. В молекуле HCl хлор атом более электроотрицательный, чем атом водорода, поэтому электроны будут проводить больше времени около атома хлора, чем около атома водорода. Это создает неравномерное распределение электронной плотности в молекуле и вызывает образование полярной ковалентной связи.
Полярность ковалентной связи в молекуле HCl имеет важные последствия для ее свойств. Это позволяет молекуле HCl образовывать водородные связи с другими молекулами, что делает ее растворимой в воде и способной к образованию кристаллов. Также полярность связи в HCl обуславливает ее высокие температуры кипения и плавления по сравнению с некоторыми другими химическими соединениями.
Химическая связь в молекуле СаCl2
Ионная связь возникает между атомами, которые имеют большую разницу в электроотрицательности. В случае молекулы СаCl2, кальций имеет относительно низкую электроотрицательность, а хлор – высокую. Это означает, что атомы хлора притягивают электроны более сильно, чем кальций.
В результате такого неравномерного распределения электронов, атомы хлора получают отрицательный заряд, а атом кальция – положительный. Это приводит к возникновению притяжения между атомами, и они становятся связанными.
Такая ионная связь в молекуле СаCl2 обеспечивает ей стабильность и устойчивость. Атомы кальция и хлора стремятся достичь электронной конфигурации инертных газовых элементов, путем передачи или приобретения электронов. В результате этого процесса образуются положительно и отрицательно заряженные ионы, которые привлекаются друг к другу и образуют связь.
Ионные связи обычно характеризуются высокой силой и они представляют собой одну из основных форм химической связи. Она обладает рядом интересных свойств, таких как высокая температура плавления и кипения, хорошая электропроводность в растворе и гигроскопичность.
Сравнение типов химических связей в молекулах
В химии существует несколько типов химических связей, которые могут формироваться между атомами в молекулах. Рассмотрим различия между некоторыми из них на примере молекул метана, гидрида кальция, СaN2, HCl и CaCl2.
1. Неорганические соединения
Начнем с гидрида кальция (CaH2), который является типичным неорганическим соединением. В данной молекуле имеется ионная связь между ионами кальция (Ca2+) и ионами гидрида (H-). Ионная связь образуется из-за электростатического притяжения противоположно заряженных ионов.
2. Ковалентные соединения
Метан (CH4) и СaN2 — представители ковалентных соединений. В молекуле метана каждый атом углерода образует ковалентную связь с четырьмя атомами водорода. Это связь совместного использования электронов, где все атомы равноправно делят пары электронов.
СaN2 является двойной ковалентной связью между атомами кальция и азота. Ковалентная связь в данном случае возникает из-за совместного использования электрона пары.
3. Ковалентно-ионные соединения
HCl и CaCl2 — примеры ковалентно-ионных соединений. В молекуле HCl имеется полярная ковалентная связь между атомами водорода и хлора. Полярность возникает из-за разности электроотрицательностей атомов. Отрицательный заряд хлора частично притягивает положительный заряд водорода.
CaCl2 образует ионную связь между атомом кальция и ионами хлора. В данном случае атом кальция отдает два электрона и становится катионом, а ионы хлора принимают эти электроны, становясь анионами.
Заключение:
Таким образом, различные типы химических связей между атомами в молекулах имеют свои особенности и возникают из-за разных механизмов взаимодействия между атомами. Неорганические соединения образуют ионные связи, ковалентные соединения основаны на общем использовании электронов, а ковалентно-ионные соединения содержат как ионные, так и ковалентные связи.






