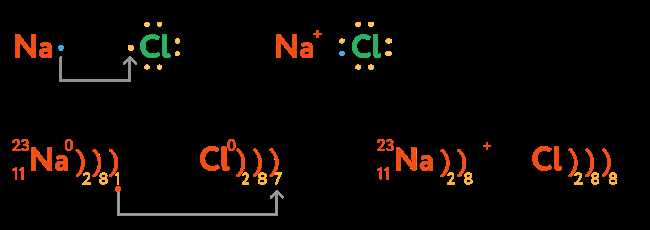
Когда мы говорим о химической связи, первым делом приходит на ум молекула. Однако, есть элементы, которые образуют связи сами с собой. Один из таких элементов — азот (N). Он способен образовывать молекулы со своим собственным атомом.
В молекуле N2 два атома азота соединены между собой тройной ковалентной связью. Эта связь весьма сильна и требует большой энергии для разрыва. Такая степень связи обусловлена наличием одного пустого 2p-орбиталя в каждом азотном атоме.
Mолекула N2 обладает особыми характеристиками. Она является бесцветным и безвкусным газом при комнатной температуре и давлении. N2 также химически инертен, что означает, что он не реагирует с большинством других элементов. Однако, в отсутствии катализатора и при высоких температурах азот в N2 может претерпевать такие реакции, как окисление или нитрирование.
Что такое химическая связь?
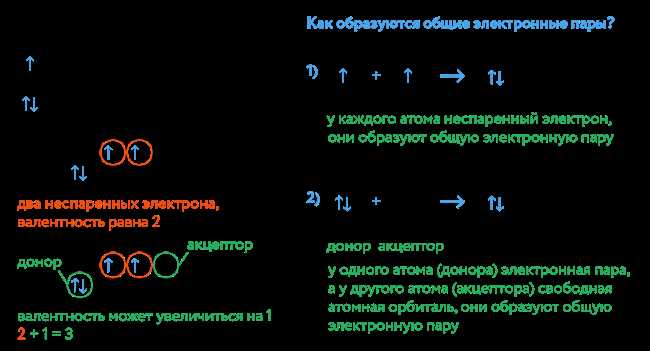
Когда атомы объединяются через химическую связь, они образуют молекулы. Молекулы вещества могут быть различных типов: простые (состоящие из одного вида атомов) и сложные (состоящие из разных видов атомов).
Химическая связь имеет несколько особенностей:
- Сила связи: Химическая связь может быть слабой или крепкой, в зависимости от типа вещества и энергии, необходимой для разрыва связи.
- Полярность: Связь может быть полярной или неполярной, в зависимости от того, насколько равномерно распределены электроны между атомами.
- Длина связи: Длина связи – это расстояние между ядрами связанных атомов. Она зависит от типа связи и типа атомов.
- Углы связи: В некоторых случаях связи между атомами образуют углы, которые определяют структуру молекулы и ее свойства.
Одним из примеров молекул, образующихся через химическую связь, является N2. Молекула N2 состоит из двух атомов азота, которые связаны между собой с помощью тройной химической связи. Эта связь очень крепкая, что делает молекулу N2 стабильной и негорючей.
Химическая связь имеет огромное значение в химической промышленности, медицине, экологии и других областях науки и технологий. Понимание ее особенностей и характеристик позволяет нам лучше понять свойства вещества и использовать их в нашей повседневной жизни.
Структура N2 и его связь
Посмотрим на структуру N2. Оба атома азота в молекуле N2 имеют по семь электронов в валентной оболочке. Чтобы достичь электронной конфигурации с полным внешним энергетическим уровнем, атомы азота делят свои электроны и образуют тройную связь между собой.
Тройная связь является очень сильной и стабильной. Она состоит из трех пар электронов, которые образуют облако электронной плотности между двумя атомами азота. Это облако электронной плотности обеспечивает стабильность молекулы N2 и делает ее невероятно сложной для разрушения.
Как связь N2 влияет на нашу жизнь? Хорошо вопрос! Молекула N2 является ключевым компонентом воздуха, который мы дышим. Воздух состоит примерно на 78% из азота, и большая часть этого азота представляет собой молекулы N2.
Азот является необходимым элементом для растений. Они используют азот для синтеза белков и других важных органических соединений. Таким образом, молекула N2 играет решающую роль в питательном цикле растений.
А как насчет использования N2 в других областях? О, тут у нас есть еще много интересного! Молекула N2 широко применяется в индустрии, в том числе в качестве инертного газа для защиты от окисления и коррозии, в освещении, в обогащении радиочувствительного оборудования и многих других областях. Его уникальная связь и структура делают его незаменимым компонентом во многих процессах.
Особенности химической связи в N2
1. Двойная связь. В N2 обе атомы азота соединены двойной связью, что делает молекулу азота стабильной и инертной. Двойная связь представляет собой совместное использование двух электронов, каждый из атомов азота делит одно из своих электронов с другим атомом. Это приводит к образованию двух связей между атомами.
2. Кратность связи. Взаимодействие между атомами азота в молекуле N2 осуществляется посредством трех пар электронов. Такие связи называются трехэлектронными или тройными. Кратность связи указывает на количество электронных пар, совместно используемых атомами. В молекуле N2 образована тройная связь, что делает ее очень стабильной и нереактивной.
3. Длина связи. Длина связи между атомами азота в молекуле N2 составляет около 109 пикометров (1 пикометр равен 10^(-12) метра). Это достаточно короткая связь, что свидетельствует о сильном притяжении между атомами их ядерами. Кроме того, короткая длина связи указывает на высокую степень насыщенности области связи электронами, что придает молекуле N2 большую стабильность и инертность.
4. Геометрия молекулы. Молекула N2 имеет линейную геометрию, то есть атомы азота располагаются на одной прямой линии. Это связано с тем, что тройная связь между атомами требует специфической ориентации атомов в пространстве. Линейная геометрия молекулы N2 способствует ее стабильности и инертности.
5. Инертность. Молекула N2 обладает высокой инертностью, то есть не проявляет активности при обычных условиях. Это связано с высокой степенью насыщенности области связи электронами и линейной геометрией молекулы. Инертность молекулы N2 придает ей стабильность и позволяет использовать ее в различных сферах, например, в промышленности и в качестве атмосферного газа.
Характеристики химической связи в N2

Межатомные расстояния в молекуле N2 составляют около 109 пикометров (1 пикометр равен 10^-12 метров). Длина связи в молекуле N2 равна около 110 пикометров, что делает эту связь очень короткой и сильной. Кроме того, молекула N2 обладает высокой симметрией, что делает ее чрезвычайно стабильной и устойчивой к химическим реакциям.
- Общая химическая формула: N2
- Количество связей: 1
- Тип связи: ковалентная
- Межатомное расстояние: около 109 пикометров
- Длина связи: около 110 пикометров
- Симметрия молекулы: высокая
Химическая связь в молекуле N2 играет важную роль в биологических и промышленных процессах. Например, азотная группа в аминокислотах является одним из основных строительных блоков белков, а также азот используется в производстве удобрений и взрывчатых веществ. Изучение химической связи в молекуле N2 помогает нам лучше понять ее свойства и влияние на различные области науки и промышленности.






