Молекула воды – это основная структурная единица воды и причина ее уникальных свойств. Химическая связь в молекуле воды представляет собой ковалентные связи между атомами водорода и атомом кислорода.
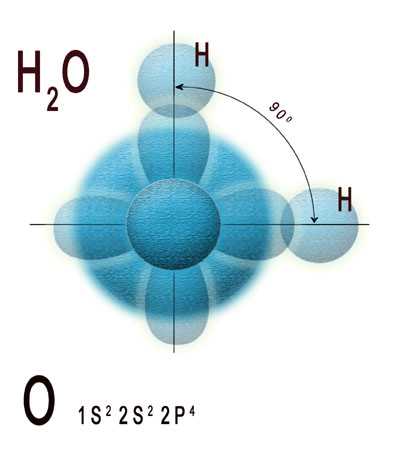
Структура молекулы воды имеет форму «гидроксильного» углового соединения, где два атома водорода связаны с одним атомом кислорода. Угол между атомами водорода около 104,5 градуса.
Эта уникальная структура молекулы воды обусловливает ее значительные физические и химические свойства. Например, поларность молекулы воды делает ее хорошим растворителем для многих веществ и обуславливает ее поверхностное натяжение и способность образовывать водородные связи.
Понимание химической связи в молекуле воды и ее структуры является ключевым для понимания многих физических и химических процессов, включая растворение, кипение, кристаллизацию и химические реакции с участием воды.
Структура молекулы воды
Вода имеет форму буквы V или угол, с которым она молекулы соединяется. Она может складываться, и потом вновь разрываться. Такое взаимодействие между молекулами воды придает ей много полезных свойств.
Вот основные характеристики структуры молекулы воды:
- Атомы: Молекула воды состоит из трех атомов – двух атомов водорода (H) и одного атома кислорода (O). Атомы водорода находятся на одной стороне атома кислорода и образуют угол около 104,5 градусов.
- Электроны: Каждый атом воды имеет свои электроны. Атом кислорода имеет 8 электронов, два из которых образуют связи с атомами водорода. Атомы водорода, в свою очередь, имеют по одному электрону, который образует связь с атомом кислорода.
- Связи: Молекула воды содержит две ковалентные связи между атомом кислорода и двумя атомами водорода. Ковалентная связь – это сильная химическая связь, которая образуется, когда два атома делят электроны между собой. Именно эта связь объединяет атомы водорода и атом кислорода в молекуле воды.
Что же делает молекулу воды такой особенной? Ее свойства связаны с взаимодействием между разными молекулами воды. Каждая молекула воды формирует четыре связи weak с соседними молекулами воды. Эти weak связи называются водородными связями. Они не так сильны, как ковалентные связи, но при этом они способны создавать много интересных явлений и свойств.
Вода – это замечательное вещество, которое обладает уникальными свойствами. Она способна поглощать тепло и передавать его, что делает ее хорошим теплоносителем. Вода также обладает поверхностным натяжением, благодаря которому она может образовывать капли на поверхности и позволяет живым организмам передвигаться по ней. Это только несколько примеров из множества свойств, которыми обладает вода благодаря структуре ее молекулы.
Таким образом, структура молекулы воды с ее атомами, электронами, ковалентными и водородными связями создает уникальные характеристики воды и позволяет ей играть важную роль во многих процессах на Земле и в жизни организмов.
Полярность молекулы воды
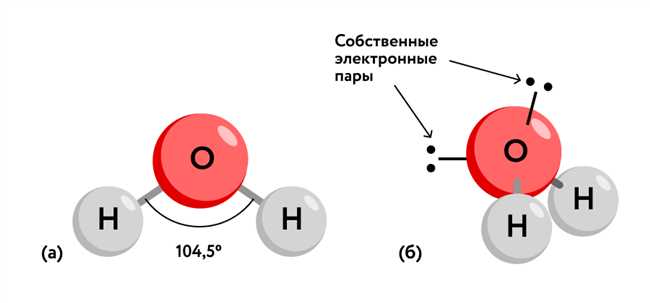
Молекула воды имеет форму буквы «V», где атом кислорода занимает центральное положение, а два атома водорода расположены вблизи него. Интересно, что эта форма не является симметричной – угол между атомами водорода составляет около 104.5 градусов.
Итак, как же эта несимметричная форма молекулы воды влияет на ее полярность? Дело в том, что атомы водорода обладают положительным зарядом, а атом кислорода – отрицательным зарядом. Это происходит из-за разницы в электроотрицательности между водородом и кислородом. В результате, молекула воды становится полярной – у нее есть полюс с положительным зарядом, обусловленным водородом, и полюс с отрицательным зарядом, обусловленным кислородом.
Полярность молекулы воды играет важную роль во многих физических и химических процессах. Она позволяет водной среде легко взаимодействовать с другими полярными или ионными веществами, образуя водородные связи или притяжение между частичками этих веществ. Это объясняет, почему вода способна растворять множество различных веществ, а также почему она обладает высокой коэрзией – способностью сцепляться между молекулами.
Полярность молекулы воды также обуславливает ее поверхностное натяжение. Вода на поверхности образует «пленку», которая имеет способность удерживать небольшие объекты на своей поверхности, например, насекомых или иголки. Это явление объясняется тем, что на поверхности воды молекулы ориентированы внизумолекулуами и не могут образовывать взаимодействия с воздухом, что создает эффект «упругой» поверхности.
Однако, остается вопрос, почему молекула воды обладает такой формой, которая делает ее полярной? Что заставляет атомы водорода отклоняться от прямой линии и образовывать угол 104.5 градусов? Ответ связан с электронной структурой атомов водорода и кислорода, их взаимодействием при образовании связи. Но это уже совсем другая история…
Гидрофильность и гидрофобность
Что ж, давайте разберемся. Вода — уникальное вещество, имеющее положительный и отрицательный конец, вызванные поляризацией значительно отличающимися атомами кислорода и водорода в молекуле. Это приводит к возникновению силы, известной как водородная связь, которая обеспечивает структуру и свойства воды.
Молекулы, которые обладают возможностью образовывать водородные связи с водой, являются гидрофильными. Эти молекулы обычно имеют полярный характер, то есть они имеют неравномерное распределение электронов и разделение зарядов. Примерами гидрофильных молекул являются соль, сахар, аминокислоты и многие другие вещества. Они хорошо растворяются в воде и могут образовывать гидратированные ионы или молекулы, окруженные оболочкой водных молекул.
С другой стороны, гидрофобные молекулы являются неполярными и неспособны образовывать водородные связи с водой. Эти молекулы обычно состоят из атомов водорода и углерода и имеют симметричную структуру. Примерами гидрофобных молекул являются жиры, масла и воски. Они плохо растворимы в воде и образуют отдельные капли или слои поверхности, показывая гидрофобные свойства.
Теперь вы должны задаться вопросом, почему гидрофильность и гидрофобность так важны? Что это значит в контексте нашей повседневной жизни? Водорастворимые молекулы, такие как соль или сахар, являются основой для создания растворов, используемых в медицине, пищевой промышленности и других отраслях. Гидрофобные молекулы, например, используются в косметике и лубрикантах. Важно понимать свойства гидрофильности и гидрофобности для разработки новых материалов и технологий, а также для облегчения понимания биологических процессов в организме.
Основные свойства воды
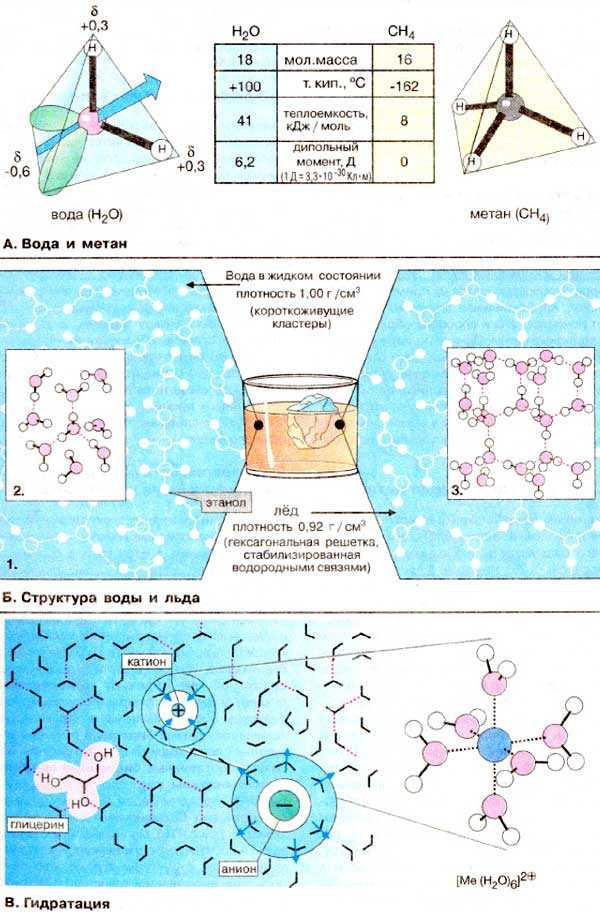
1. Полярность и способность образовывать водородные связи. Вода является полярным соединением, так как электроотрицательность атомов кислорода и водорода в молекуле воды несовпадает. Полярность воды позволяет ей образовывать водородные связи между отдельными молекулами, что обуславливает многие ее уникальные свойства. Водородные связи создают сильное притяжение между молекулами воды, образуя структуру, в которой каждая молекула воды связана с другими четырьмя молекулами воды.
2. Высокая плотность в жидком состоянии и низкая плотность в твердом состоянии. Вода при понижении температуры сначала сжимается, а затем расширяется, что приводит к аномальной плотности в жидком и твердом состояниях. Это свойство воды позволяет ей плавать на поверхности и обеспечивает сохранение жизни в водных экосистемах в зимний период.
3. Высокая удельная теплоемкость. Удельная теплоемкость воды является одной из самых высоких среди известных веществ. Это свойство позволяет воде поглощать и отдавать большое количество тепла без существенного изменения температуры окружающей среды. Водная среда способствует поддержанию стабильных температур в океанах и внутренних водоемах, что важно для развития и существования разнообразных организмов.
4. Высокое поверхностное натяжение. Вода обладает высоким поверхностным натяжением, что позволяет ей образовывать капли и пленки на поверхности. Это свойство имеет важное значение для растений и некоторых животных, которые используют поверхностное натяжение воды для перемещения или захвата добычи.
5. Универсальный растворитель. Вода является прекрасным растворителем для многих веществ благодаря своей полярности и способности образовывать водородные связи. Это позволяет ей переносить и растворять различные химические соединения, что играет важную роль в биологических системах, в том числе в процессах пищеварения и транспорте питательных веществ в организмах.
Основные свойства воды делают ее уникальным и незаменимым веществом для живых организмов и для поддержания жизни на Земле в целом. Изучение этих свойств является важной задачей химической науки и имеет практическое значение во многих областях, включая биологию, медицину, экологию и технологию.






