Химическая связь в молекуле хлороводорода осуществляется за счет образования ковалентной связи между атомами водорода и хлора. В данном случае, водород пердает свою единственную пару электронов атому хлора, образуя связь. Эта связь является полярной, так как атомы водорода и хлора имеют различные электроотрицательности. В результате, положительный заряд водородного атома частично притягивает электроны области связи, создавая положительный полюс. Атом хлора, наоборот, приобретает негативный заряд, образуя отрицательный полюс. Кристаллическая решетка хлороводорода характеризуется молекулярной структурой, в которой молекулы хлороводорода располагаются в виде цепочек, связанных слабыми взаимодействиями. Эти слабые взаимодействия обеспечивают веществу низкую температуру кипения и плавления.
Химическая связь и ее роль в структуре вещества

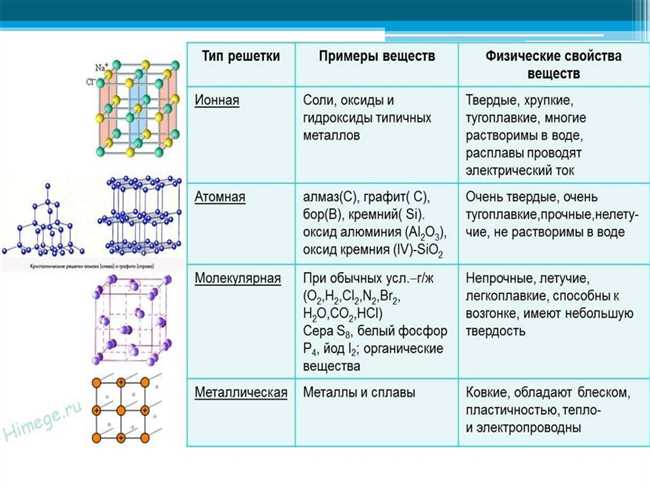
Когда атомы образуют химическую связь, они делят свои электроны. В результате этого обмена или совместного использования электронов образуется электронная оболочка, стабилизирующая систему. Химическая связь может быть ионной, ковалентной или металлической.
Ионная связь возникает между атомами, которые имеют противоположные заряды. Например, натрий имеет положительный заряд, а хлор имеет отрицательный заряд. Когда они взаимодействуют, натрий отдает один электрон хлору, образуя ионный комплекс. Этот обмен электронами создает прочную связь между атомами, что приводит к образованию кристаллической решетки.
Ковалентная связь, в отличие от ионной связи, возникает между атомами сравнительно одинакового электронного состояния. Атомы делят свои электроны таким образом, чтобы оба атома имели полную валентную оболочку. Такая связь образуется в молекулах, где атомы обменивают пары электронов, что обеспечивает стабильность системы.
Металлическая связь, с другой стороны, возникает в металлах, где множество атомов образуют решетку, которая состоит из положительных ионов и облака свободных электронов. Эти электроны свободно передвигаются по решетке металла, обеспечивая такие важные свойства, как электропроводность и теплопроводность.
Таким образом, химическая связь играет важную роль в структуре вещества. Она определяет физические и химические свойства материала, такие как температура плавления, твердость, электропроводность и т. д. Благодаря химической связи атомы объединяются в структуры, которые обеспечивают устойчивость и функциональность вещества.
Надеюсь, теперь вы имеете лучшее представление о химической связи и ее роли в структуре вещества. Необходимо учитывать, что это всего лишь общая информация, а химическая связь — широкая и глубокая тема. Приглашаю вас продолжать изучать и удивляться удивительному миру химии! Если у вас есть вопросы или комментарии, не стесняйтесь задавать их!
Общая химическая формула и физические свойства хлороводорода
Первое, что нужно знать о хлороводороде, это его состояние при комнатной температуре. Он представляет собой газ без цвета и запаха. Да, не смотришь на него, а совсем не ожидаешь! Но это не означает, что он не опасен. Хлороводород является сильным раздражителем, и его пары могут вызывать серьезные ожоги и повреждения организма. Поэтому очень важно обращаться с хлороводородом с осторожностью.
Температура кипения хлороводорода очень низкая — всего около -85,05°C. Это означает, что при комнатной температуре и атмосферном давлении хлороводород существует в виде газа. Однако, если снизить температуру ниже -85,05°C, он может перейти в жидкое состояние. В этом состоянии хлороводород обладает некоторыми особенными свойствами, например, он может быть использован в качестве очень холодного охлаждающего вещества.
Но это еще не все! Хлороводород также обладает важными свойствами растворимости. Он хорошо растворяется в большинстве органических растворителей, таких как этанол и ацетон. Также он может растворяться в некоторых неорганических растворителях, таких как вода. Если ты когда-нибудь будешь работать с хлороводородом, обязательно помни, что растворы этого вещества очень коррозионны и могут причинить вред оборудованию!
Ух, много информации, верно? Но это далеко не все, что можно сказать об хлороводороде. Так что, если у тебя остались вопросы или ты хочешь узнать еще больше, не стесняйся задавать их — я всегда готов погрузиться в мир химии вместе с тобой!
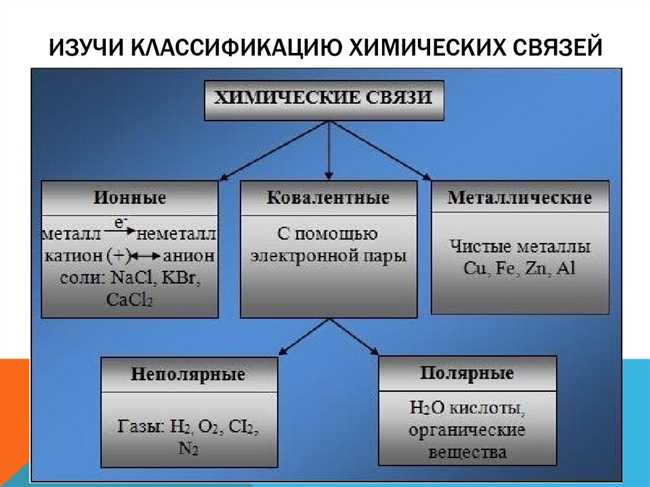
Особенности кристаллической решетки хлороводорода
Кристаллическая решетка хлороводорода является простой кубической решеткой, что означает, что атомы хлора и водорода располагаются в узлах решетки, формируя кубическую структуру. Каждый атом хлора окружен четырьмя атомами водорода, и каждый атом водорода окружен одним атомом хлора.
Межатомные расстояния в кристаллической решетке хлороводорода имеют определенные характеристики. Расстояние между атомами хлора и водорода составляет около 1,27 ангстрема. Это расстояние является оптимальной точкой баланса между электростатической притяжением между разноименно заряженными атомами и отталкиванием между одноименно заряженными атомами.
Кристаллическая решетка хлороводорода также обладает свойством анизотропии, что означает, что ее физические свойства, такие как вязкость и теплопроводность, зависят от направления. Например, вязкость хлороводорода может меняться в зависимости от направления, в котором двигаются его молекулы в решетке.
Еще одной особенностью кристаллической решетки хлороводорода является ее динамическая природа. Атомы хлора и водорода в решетке находятся в постоянном движении, осуществляя вибрационные и ротационные движения. Это движение может быть описано с помощью квантовой механики и статистической физики.
Общими особенностями кристаллической решетки хлороводорода являются ее компактность и симметрия. Каждый атом хлора и водорода имеет определенное положение в решетке, которое хорошо определено и повторяется в пространстве. Это обеспечивает регулярную и упорядоченную структуру, которая может быть описана с помощью математических моделей и кристаллографических методов.
Сводка:
- Кристаллическая решетка хлороводорода — простая кубическая решетка
- Межатомные расстояния составляют около 1,27 ангстрема
- Решетка обладает анизотропией и динамической природой
- Решетка компактна, симметрична и хорошо упорядочена
Таким образом, кристаллическая решетка хлороводорода обладает рядом особенностей, которые определяют ее структуру и свойства. Изучение этих особенностей важно для понимания молекулярных и физических свойств хлороводорода, а также для применения его в различных областях науки и техники.
Типы кристаллической решетки хлороводорода
Гексагональная решетка:
Гексагональная решетка хлороводорода представляет собой решетку, состоящую из молекул HCl, расположенных в вершинах правильных шестиугольников. Такая решетка имеет высокую структурную устойчивость и обычно образуется при низких температурах и давлениях. Гексагональная решетка стабильна в диапазоне температур от -120 °C до -50 °C и давлениях примерно от 0,5 ГПа до 1,5 ГПа.
Кубическая решетка:
Кубическая решетка хлороводорода представляет собой решетку, состоящую из молекул HCl, расположенных в вершинах кубов. Такая решетка обычно образуется при более высоких температурах и давлениях. При повышении температуры и давления относится к типу кубического решения.
Вцелом, тип кристаллической решетки хлороводорода зависит от условий окружающей среды, в которой он образуется. Гексагональная решетка преобладает в низкотемпературный и низкодавлений условиях, в то время как кубическая решетка обычно образуется при более высоких температурах и давлениях.






