
Высший оксид азота — это химическое соединение, образованное при взаимодействии азота и кислорода. Он также известен как азотная кислота или оксид азота(V). Формула этого соединения — NO2. Имеет газообразное состояние при комнатной температуре и может образовывать кислотные растворы. Высший оксид азота является сильным окислителем и реагирует с металлами, образуя соответствующие нитраты. Он также играет роль в атмосферно-химических реакциях и может быть образован в результате выбросов из промышленных и автотранспортных источников. Кроме того, высший оксид азота имеет значительное значение в медицине, где используется в качестве лекарственного препарата для расширения дыхательных путей. Это важное соединение, которое имеет множество свойств и применений в различных областях науки и технологии.
Структура и формула высшего оксида азота
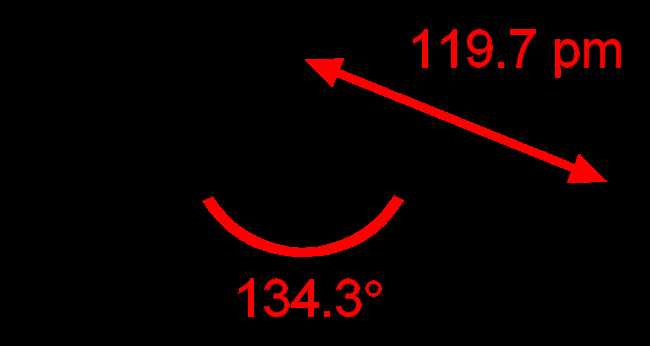
Высший оксид азота, также известный как динитроген пентаоксид или азотистый гексоксид, имеет формулу N2O5. Этот соединение состоит из двух атомов азота и пяти атомов кислорода, связанных в молекуле.
Структура N2O5 можно описать как пару молекул азотного тетраоксида (N2O4), связанных вместе по общим атомам кислорода. Каждый атом азота в молекуле N2O5 образует три связи с атомами кислорода, а каждый атом кислорода образует только одну связь с атомом азота.
Формула N2O5 указывает, что в одной молекуле высшего оксида азота содержится два атома азота и пять атомов кислорода. Такая композиция обусловлена стехиометрическими соотношениями между атомами азота и кислорода, которые образуют данное соединение.
Интересно, каким образом такие простые элементы, как азот и кислород, могут образовать такую сложную структуру, как высший оксид азота? Оказывается, это связано с электронной конфигурацией атомов и способностью атомов азота и кислорода образовывать связи друг с другом.
Эти связи между атомами азота и кислорода называются ковалентными связями, что означает, что они образуются путем обмена электронами между атомами. В молекуле N2O5 каждый атом азота обладает двумя несвязанными электронными парами, а каждый атом кислорода одной. Эти несвязанные электронные пары влияют на геометрию молекулы и взаимное расположение атомов.
Структура и формула N2O5 являются ключевыми аспектами его свойств и реактивности. На практике высший оксид азота используется в различных химических процессах, включая производство азотной кислоты и использование как окислителя в ракетных топливах.
Физические свойства
Одной из удивительных особенностей высшего оксида азота является его способность быстро реагировать с водой. При контакте с водой он быстро диссоциирует на два молекулярных оксида азота, что приводит к образованию азотной кислоты. Именно по этой причине оксид азота регулярно используется в качестве катализатора в различных химических реакциях.
Кроме того, высший оксид азота обладает высокой растворимостью в воде и других поларных растворителях. Это делает его полезным в качестве азотной кислоты, которая часто используется в лабораториях и промышленности.
Химические свойства
Высший оксид азота обладает такими химическими свойствами, которые делают его незаменимым в различных промышленных процессах и научных исследованиях. Предлагаю рассмотреть наиболее важные из них.
1. Кислотность

Высший оксид азота относится к кислотным оксидам, поэтому растворяется в воде, образуя кислоту. Образование кислоты происходит в результате реакции оксида азота с водой:
N2O5 + H2O -> 2HNO3
Эта реакция является очень экзотермической, то есть сопровождается выделением большого количества тепла. Поэтому при добавлении высшего оксида азота в воду происходит интенсивное нагревание раствора.
2. Окислительные свойства
Высший оксид азота также является сильным окислителем. Он обладает способностью окислять другие вещества, в том числе металлы. Например, при взаимодействии с железом возникает сильно окрашенное соединение, называемое ферросоединением:
N2O5 + 10Fe -> 5Fe2O3 + N2
Также оксид азота может действовать на органические вещества, вызывая их окисление. Это свойство широко используется в процессе нитрирования органических соединений.
3. Реакция с аммиаком
Аммиак (NH3) и высший оксид азота образуют нестабильное соединение, называемое гидражидом азота. Это соединение обладает взрывоопасными свойствами и часто используется в качестве реактивного вещества:
N2O5 + 2NH3 -> N2H4 + 2HNO3
Гидразин (N2H4) в свою очередь может быть использован в производстве ракетного топлива или как реактив в различных химических реакциях.
Такие химические свойства высшего оксида азота делают его неотъемлемой частью различных процессов и исследований в области химии и промышленности. Он широко используется в производстве кислот, оксидации органических соединений и многих других процессах.
Применение
Высший оксид азота (NO2) имеет широкий спектр применения в различных промышленных отраслях. Его основные области применения включают:
- Производство удобрений: NO2 является важным компонентом при производстве азотных удобрений, таких как салипат, синтетический аммиак и нитроаммофос.
- Производство кислорода: Высший оксид азота играет роль в процессе получения кислорода, используемого в различных промышленных и медицинских целях.
- Производство азотной кислоты: NO2 используется при производстве азотной кислоты, которая широко применяется в различных отраслях, включая химическую, фармацевтическую и пищевую промышленности.
- Очистка воздуха: Диоксид азота применяется в системах очистки воздуха для снижения содержания вредных газов, таких как диоксид серы и угарный газ.
- Производство пластмассы: NO2 используется в качестве компонента при производстве различных типов пластмасс, включая полиуретаны и полиамиды.
Высший оксид азота имеет множество применений, и его значение в промышленности и научных исследованиях продолжает расти. Он остается объектом дальнейших исследований и разработок, направленных на его оптимальное использование и минимизацию отрицательного воздействия на окружающую среду.






