- Связанные химические реакции
- Гидратация кальция оксида и фосфорной кислоты
- Образование кальция фосфата
- Химическое реагирование: основные аспекты и примеры
- Что такое химическое реагирование?
- Примеры химического реагирования в повседневной жизни
- Зачем изучать химическое реагирование?
- Расчет состава конечного продукта
- Применение в промышленности

Связанные химические реакции

Когда мы говорим о химических реакциях, мы всегда представляем себе изолированные процессы, в которых одни вещества превращаются в другие. Но в реальном мире химические реакции часто связаны друг с другом. Одна реакция может привести к другой, образуя цепную реакцию.
Цепные реакции – это сложные процессы, которые происходят в узкой взаимосвязи друг с другом. Часто эти реакции происходят поэтапно: одна реакция приводит к образованию промежуточных реакционных продуктов, которые затем претерпевают последующие изменения.
Одним из примеров связанных химических реакций является взаимодействие оксида кальция (CaO) с фосфорной кислотой (H3PO4), что приводит к образованию дибазической соли: фосфата кальция (Ca3(PO4)2) и воды (H2O).
С учетом этой информации, давайте впустим в нашу лабораторию немного CaO и H3PO4! Что будет происходить?
- Сначала CaO реагирует с H3PO4, образуя ионные соединения Ca2+ и PO43-, которые образуют фосфат кальция Ca3(PO4)2.
- Затем вода (H2O) образуется в результате реакции H3PO4 с CaO. Вода становится продуктом реакции.
Вот так, с помощью связанных химических реакций мы получили фосфат кальция и воду! Но что это значит на практике?
Фосфат кальция широко используется в медицине, косметике, пищевой промышленности и сельском хозяйстве. Он может быть добавлен в пищу в качестве пищевых добавок для улучшения качества продуктов и укрепления костей. Кроме того, фосфат кальция является основным компонентом костей и зубов, что делает его важным для поддержания здоровья скелета.
Вода, получаемая в результате реакции, является жизненно важным ресурсом для нашего организма. Она участвует в большом количестве химических процессов внутри нашего тела, помогая поддерживать гомеостаз и обеспечивая правильное функционирование органов и систем.
Таким образом, связанные химические реакции, такие как взаимодействие CaO с H3PO4, позволяют нам получить важные вещества и продукты, которые играют важную роль в нашей жизни. Используйте знания о химии, чтобы улучшить мир вокруг нас!
Гидратация кальция оксида и фосфорной кислоты
Кальций оксид, известный также как негашеная известь, широко используется в строительстве и сельском хозяйстве. Он обладает высокой щелочностью и может вызывать ожоги, поэтому гидратация кальция оксида является важным процессом для безопасного использования этого вещества.
При гидратации кальция оксида, между его молекулами и молекулами воды происходит реакция, в результате которой образуется гидратированный кальций оксид или сложный соединение Ca(OH)2. Этот продукт является более безопасным для использования, так как менее щелочной и не вызывает ожогов.
Гидратированный кальций оксид находит широкое применение в строительстве, производстве керамических изделий, водоочистке и других отраслях промышленности.
Фосфорная кислота (H3PO4) – это одна из самых распространенных органических кислот, широко применяемых в промышленности и в научных исследованиях. Эта кислота имеет множество применений, включая сельское хозяйство, пищевую промышленность, фармацевтику и производство удобрений.
Гидратация фосфорной кислоты – это процесс, при котором кислота взаимодействует с водой и образует гидратированную форму. В результате гидратация фосфорной кислоты образуется раствор с кислотной средой, который может быть использован в различных сферах деятельности.
Гидратированная фосфорная кислота используется в сельском хозяйстве для подкормки растений, в производстве удобрений, а также в качестве компонента для производства пищевых добавок и фармацевтических препаратов.
Итак, гидратация кальция оксида и фосфорной кислоты – это важные процессы, которые позволяют использовать эти вещества в безопасных и эффективных целях. Знание этих процессов позволяет нам лучше понять и применять эти вещества в нашей повседневной жизни.
Образование кальция фосфата
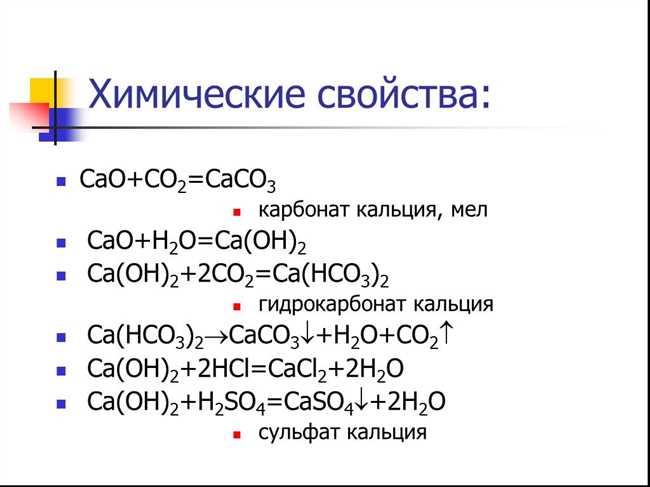
Кальций фосфат является основным компонентом костей и зубов у животных и людей. Это связано с тем, что он обладает высокой прочностью и стабильностью. Кальций фосфат также используется в производстве минеральных добавок и пищевых продуктов, таких как сыры, йогурты и молоко, для обогащения их кальцием.
Химическая реакция между CaO и H3PO4 происходит следующим образом:
- Вначале кальций оксид (CaO) реагирует с водой (H2O), образуя гидроксид кальция (Ca(OH)2).
- Затем фосфорная кислота (H3PO4) вступает в реакцию с гидроксидом кальция, образуя кальций фосфат и воду.
Такая реакция является экзотермической, то есть выделяется тепло. Она происходит при нормальных условиях температуры и давления.
Как видно, образование кальция фосфата является жизненно важным процессом для нашего организма и промышленности. Благодаря этому соединению, мы можем поддерживать здоровье наших костей и зубов, а также использовать его в различных отраслях промышленности.
Химическое реагирование: основные аспекты и примеры
Что такое химическое реагирование?
Химическое реагирование — это процесс, при котором одни вещества превращаются в другие, сопровождаемый изменением их химических свойств. В результате реакции образуются новые вещества с различными физическими и химическими свойствами. Химические реакции могут происходить под воздействием различных факторов, таких как температура, давление, концентрация реагирующих веществ и наличие катализаторов.
Примеры химического реагирования в повседневной жизни
Теперь давай рассмотрим несколько примеров, которые помогут нам лучше понять, как химическое реагирование происходит в повседневной жизни и как оно влияет на окружающую нас среду:
- Начнем с очень простого примера — горения свечи. Когда мы зажигаем свечу, воск и кислород воздуха реагируют друг с другом, образуя воду, углекислый газ и тепло. Именно благодаря этой химической реакции свеча горит и излучает свет и тепло.
- Еще один пример — реакция между кислотой и основанием. Например, если мы смешаем раствор алюминиевой фольги с раствором щелочи, произойдет химическая реакция, в результате которой образуется гидроген и соль. Эта реакция также сопровождается выделением тепла.
Это только некоторые примеры химического реагирования в повседневной жизни. Мы можем встретить этот процесс во многих других случаях, от украшения пищи до производства лекарств и материалов.
Зачем изучать химическое реагирование?
Ты можешь спросить: зачем нам нужно изучать химическое реагирование? Ответ прост: это помогает нам лучше понять и контролировать мир вокруг нас. Понимание химических реакций позволяет нам разрабатывать новые материалы, изобретать новые лекарства, создавать энергетически эффективные процессы и многое другое.
Кроме того, изучение химического реагирования помогает понять законы природы и нашу роль в этом процессе. Мы можем стать ответственнее к нашей планете, разрабатывая более экологичные и энергоэффективные методы в различных отраслях промышленности.
Интересно, правда? Химическое реагирование — это увлекательная область науки, которая продолжает раскрывать свои тайны и вносить существенный вклад в развитие технологий и знаний. Продолжай участвовать в этом загадочном танце молекул и быть вдохновленным новыми открытиями в химии!
Расчет состава конечного продукта

Когда мы проводим химическую реакцию между кальцием оксидом (CaO) и фосфорной кислотой (H3PO4), мы получаем продукт. Но какая будет составляющая этого конечного продукта? Давайте вместе разберемся!
Чтобы рассчитать состав конечного продукта, нам необходимо знать соотношение между реагентами и их стехиометрические коэффициенты. Стехиометрия показывает, в каких пропорциях реагенты превращаются в продукты.
Итак, в нашей реакции между CaO и H3PO4 мы имеем один моль CaO и один моль H3PO4.
Согласно стехиометрическому соотношению, один моль CaO реагирует с одним моль H3PO4. Таким образом, все мольные единицы будут полностью переведены в продукты.
Конечный продукт этой реакции будет содержать соль кальция и воду. Формула этой соли будет Ca(H2PO4)2.
Теперь давайте проанализируем состав этой соли. Она содержит ионы кальция (Ca2+) и ионы гидрогенфосфата (H2PO4-). Эти ионы образуют кристаллическую решетку в составе Ca(H2PO4)2, что является конечным продуктом реакции.
Важно отметить, что в процессе реакции также выделяется вода (H2O). Вода образуется в результате реакции между водородными и кислородными ионами из фосфорной кислоты и кальция оксида.
Таким образом, расчет состава конечного продукта позволяет нам определить, что Ca(H2PO4)2 и H2O будут основными компонентами, полученными из реакции между CaO и H3PO4.
Итак, после проведения расчетов мы можем утверждать с уверенностью, что конечный продукт реакции CaO и H3PO4 будет содержать соль кальция Ca(H2PO4)2 и воду H2O. Эта информация не только помогает нам понять структуру и состав продукта, но и может быть полезна в различных промышленных процессах или научных исследованиях, где эта реакция играет важную роль.
Применение в промышленности
Одним из главных применений этой реакции является производство фосфорной кислоты (H3PO4), которая широко используется в пищевой промышленности, производстве удобрений, стекла, моющих средств и других продуктов. Кальцийфосфат, полученный в результате реакции CaO и H3PO4, является основным компонентом фосфатных удобрений. Он содержит необходимый для роста растений фосфор, который является одним из основных питательных веществ для растений.
Также реакция CaO и H3PO4 используется в производстве керамических материалов, стекла, а также при производстве фармацевтических субстанций. Благодаря своим высоким химическим свойствам эта реакция нашла широкое применение в различных отраслях промышленности, где требуется получение фосфорсодержащих соединений.






